
| A、在澄清石灰水中通入过量CO2:CO2+2OH-=CO32-+H2O | ||||
B、用惰性电极电解Cu(NO3)2溶液:Cu2++2OH-
| ||||
| C、将足量Cl2通入到FeI2溶液中:3Cl2+2Fe2++4I-=2I2+6Cl-+2Fe3+ | ||||
| D、金属Al溶于氢氧化钠溶液中:Al+2OH-=AlO2-+H2↑ |
| ||


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
 小明同学在学习“硫酸及其盐的某些性质与用途”的过程中,进行如下实验探究.
小明同学在学习“硫酸及其盐的某些性质与用途”的过程中,进行如下实验探究.| 实验操作 | 预期现象和结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 |
| 开始沉淀(pH) | 2.3 | 7.5 | 7.6 | 3.4 |
| 完全沉淀(pH) | 4.1 | 9.7 | 9.2 | 5.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、④⑤ | B、①④ | C、②③ | D、③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A |
| 3 |
| 3A |
| 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| X Y Z |
0.1g | 0.3g | 0.5g |
| 1.5% | 223g | 67s | 56s |
| 3.0% | 308s | 109s | 98s |
| 4.5% | 395s | 149s | 116s |
查看答案和解析>>
科目:高中化学 来源: 题型:
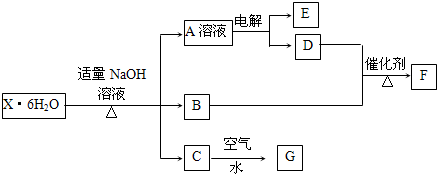
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol H3PO4能消耗3 NaOH |
| B、10.6 g Na2CO3晶体含有0.1 NA CO32- |
| C、6.4 g Cu被氧化失去的电子数一定为2 NA |
| D、甘油和甲苯的混合液4.6 g含有2.5 NA质子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com