
| A. | 若容器底部没有固体,则溶液中只有Cu2+ | |
| B. | 若容器底部固体既有铜又有铁,则溶液中只有Fe2+ | |
| C. | 若容器底部固体为铜,则溶液中可能有Cu2+和Fe3+ | |
| D. | 若容器底部无固体,再加入铁粉,溶液中阳离子的种类不发生变化 |
分析 Fe与氯化铁和氯化铜反应:2FeCl3+Fe=3FeCl2,CuCl2+Fe=FeCl2+Cu,氧化性:Fe3+>Cu2+>Fe2+,因此铁粉先跟Fe3+反应,从而确定固体的成分、溶液的成分,以此解答该题.
解答 解:A.当溶液中Fe3+过量,铁粉不足时,反应只发生2FeCl3+Fe=3FeCl2,而且Fe3+有剩余,所以溶液中的金属离子Cu2+、Fe2+和Fe3+,故A错误;
B.当铁粉过量,发生2FeCl3+Fe=3FeCl2,CuCl2+Fe=FeCl2+Cu,溶液中只有Fe2+,故B正确;
C.若容器底部固体为铜,因发生2FeCl3+Cu=2FeCl2+CuCl2,所以溶液中一定不存在Fe3+,故C错误;
D.若容器底部无固体,再加入铁粉,可能发生CuCl2+Fe=FeCl2+Cu,Cu2+全部反应,则溶液中阳离子的种类发生变化,故D错误;
故选B.
点评 本题考查了Fe3+、Cu2+的氧化能力大小的比较,侧重学生的分析能力的考查,能正确判断固体的成分是解本题的关键,根据固体的成分了解反应的先后顺序,从而确定溶液的成分,题目难度中等.


 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案科目:高中化学 来源: 题型:解答题
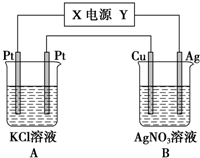 Na、Fe、Cu、Al是常见的金属元素,请按要求回答下列问题:
Na、Fe、Cu、Al是常见的金属元素,请按要求回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(A-)>c(B+)>c(H+)>c(OH-) | B. | c(B+)>c(A-)>c(OH-)>c(H+) | ||
| C. | c(B+)+c (H+)>c(A-)+c(OH-) | D. | c(B+)>c(A-)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MnO2、CuO、Fe三种物质的粉末都是黑色的,用稀盐酸不能将它们区别开 | |
| B. | (NH4)2SO4、K2SO4、NH4Cl三种溶液可以用加入NaOH溶液并加热的方法区分开 | |
| C. | 除去KNO3中的少量NaCl,可将混合物制成热的饱和溶液,冷却结晶,过滤 | |
| D. | 用湿润的KI淀粉试纸可以检验溴蒸气中是否含有NO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等浓度的两溶液中水的电离程度:HCl>BOH | |
| B. | BOH的电离方程式是BOH?B++OH- | |
| C. | 混合溶液中:c(B)+>c(OH-)>c(Cl-)>c(H)+ | |
| D. | 要使混合溶液的pH=7,则需VHCl>VBOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1氨水溶液:K+、Na+、NO3-、AlO2- | |
| B. | 0.1mol•L-1Fe(NO3)2溶液:H+、Al3+、SO42-、Cl- | |
| C. | 滴入酚酞显红色的溶液:Na+、Mg2+、NO3-、HSO3- | |
| D. | 由水电离出的c(H)=10-11mol•L-1的溶液:Ca2+、NH4+、Cl-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com