
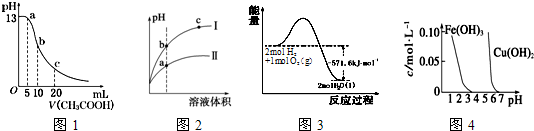
| A. | 图l表示常温下向体积为10mL0.1mol•L-1NaOH溶液中逐滴加入O.1mol•L-1CH3COOH液后溶液的pH变化曲线,则b点处有:c(CH3COOH)+c(H+)=c(OH-) | |
| B. | 图2表示用水稀释pH相同的盐酸和醋酸时溶液的pH变化曲线,其中I表示醋酸,II表示盐酸,且溶液导电性:c>b>a | |
| C. | 图3表示H2与O2发生反应过程中的能量变化,H2的燃烧热为285.8kJ.mol-1 | |
| D. | 由图4得出若除去CuSO4溶液中的Fe3+,可采用向溶掖中加入适量CuO,调节溶液的pH至4 |
分析 A.b点二者恰好反应生成醋酸钠,溶液呈碱性,溶液中存在质子守恒;
B.加水稀释pH相同的盐酸和醋酸,醋酸继续电离出氢离子而导致醋酸溶液中c(H+)大于盐酸,稀释相同的倍数时,pH变化大的是盐酸、变化小的是盐酸;溶液导电性与离子浓度成正比;
C.2mol氢气完全燃烧生成液态水放出571.6kJ热量,1mol氢气完全燃烧生成液态水放出285.8kJ热量;
D.除去CuSO4溶液中的Fe3+,要使铁离子除去但不能除去铜离子,根据溶液pH与产生沉淀的关系知,当pH=4时氢氧化铁完全沉淀.
解答 解:A.体积为10 mL 0.1 mol•L-1NaOH溶液中逐滴加入0.1 mol•L-1 CH3COOH溶液后,所得的溶液是醋酸钠溶液,存在质子守恒c(CH3COOH)+c(H+)=c(OH-),故A正确;
B.用水稀释pH相同的盐酸和醋酸,盐酸的pH变化较大,醋酸的pH变化小,溶液的导电能力取决于自由移动离子的浓度的大小,即其中Ⅰ表示盐酸,Ⅱ表示醋酸,且溶液导电性:c>b>a,故B错误;
C、氢气在氧气中燃烧的反应是放热的,燃烧热是完全燃烧1mol氢气生成稳定产物液态水所放出的热量,即H2的燃烧热为285.8 kJ•mol-1,故C正确;
D、除去CuSO4溶液中的Fe3+,向溶液中加入适量CuO,调节溶液的pH至4左右,铁离子水解完全转化为氢氧化铁铁沉淀,可以除去CuSO4溶液中的Fe3+,故D正确.
故选B.
点评 本题考查图象分析,涉及除杂、燃烧热、弱电解质的电离及溶液导电性等知识点,明确图象中曲线变化趋势及拐点的含义是解本题关键,易错选项是B,注意溶液导电性与离子浓度成正比,与电解质强弱无关,题目难度不大.


科目:高中化学 来源: 题型:填空题
 N2H+5+OH-,25℃时水溶液中肼与强酸反应结合一个质子的平衡常数Kb1=$\frac{c({N}_{2}{{H}_{5}}^{+})}{c({N}_{2}{H}_{4})×c({H}^{+})}$.常温下,若将2mol/LN2H4•H20溶液与1.3mol/L硫酸溶液等体积混合,则溶液中各微粒(离子及N2H4•H2O)浓度由大到小的顺序为c(N2H5+)>c(SO4-)>c(N2H62+)>c(H+)>c(N2H4)>c(OH-).
N2H+5+OH-,25℃时水溶液中肼与强酸反应结合一个质子的平衡常数Kb1=$\frac{c({N}_{2}{{H}_{5}}^{+})}{c({N}_{2}{H}_{4})×c({H}^{+})}$.常温下,若将2mol/LN2H4•H20溶液与1.3mol/L硫酸溶液等体积混合,则溶液中各微粒(离子及N2H4•H2O)浓度由大到小的顺序为c(N2H5+)>c(SO4-)>c(N2H62+)>c(H+)>c(N2H4)>c(OH-).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入少量CH3COONa固体 | B. | 通入少量氯化氢气体 | ||
| C. | 升高温度 | D. | 加入少量氢氧化钠固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两种溶液中,水的电离程度:①>② | |
| B. | 分别中和等体积相同物质的量浓度的NaOH溶液,则消耗溶液的体积:①<② | |
| C. | 等体积的①、②溶液分别与足量铝粉反应,生成H2的质量:①=② | |
| D. | 将等体积的①、②溶液中分别稀释10倍后,溶液的pH:①>② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1氨水,溶液的pH>13 | |
| B. | 0.1 mol•L-1氨水加水稀释,溶液中c(H+)和c(OH-)都减小 | |
| C. | 0.1 mol•L-1醋酸溶液中:c(H+)=c(CH3COO-) | |
| D. | 0.1 mol•L-1醋酸与0.1 mol•L-1NaOH溶液等体积混合所得溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 用18mol/L的浓硫酸配制150.00mL 1.00mol/L硫酸:
用18mol/L的浓硫酸配制150.00mL 1.00mol/L硫酸:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com