
【题目】实验室用绿矾(FeSO4·7H2O)为原料制备补血剂甘氨酸亚铁[(H2NCH2COO)2Fe],有关物质性质如下:
甘氨酸(H2NCH2COOH) | 柠檬酸 | 甘氨酸亚铁 |
易溶于水,微溶于乙醇,两性化合物 | 易溶于水和乙醇,有酸性和还原性 | 易溶于水,难溶于乙醇 |
实验过程:
I.配制含0.10molFeSO4的绿矾溶液。
II.制备FeCO3:向配制好的绿矾溶液中,缓慢加入200mL1.1mol/LNH4HCO3溶液,边加边搅拌,反应结束后过滤并洗涤沉淀。
III.制备(H2NCH2COO)2Fe:实验装置如下图(夹持和加热仪器已省略),将实验II得到的沉淀和含0.20mol甘氨酸的水溶液混合后加入C中,然后利用A中反应产生的气体将C中空气排净,接着滴入柠檬酸溶液并加热。反应结束后过滤,滤液经蒸发结晶、过滤、洗涤、干燥得到产品。
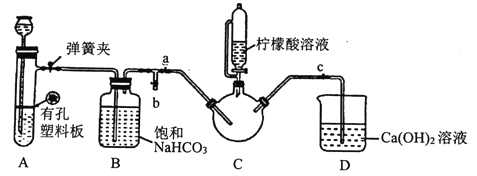
回答下列问题:
(1)实验I中:实验室配制绿矾溶液时,为防止FeSO4被氧化变质,应加入的试剂为____(写化学式)。
(2)实验II中:生成沉淀的离子方程式为________________。
(3)实验III中:
①检查装置A的气密性的方法是_________。
②装置A中所盛放的药品是_______ (填序号)。
a.Na2CO3和稀H2SO4 b.CaCO3和稀H2SO4 c.CaCO3和稀盐酸
③确认c中空气排尽的实验现象是______________。
④加入柠檬酸溶液一方面可调节溶液的pH促进FeCO3溶解,另一个作用是_______。
⑤洗涤实验III中得到的沉淀,所选用的最佳洗涤试剂是___(填序号)。
a.热水 b.乙醇溶液 c.柠檬酸溶液
⑥若产品的质量为17.34g,则产率为_____。
【答案】 Fe Fe2++2HCO3-=FeCO3↓+CO2↑+ H2O 关闭弹簧夹,从长颈漏斗注入一定量的水,使漏斗内的水面高于具支试管中的水面,停止加水一段时间后,若长颈漏斗与具支试管中的液面差保持不变,说明装置不漏气 c D中澄清石灰水变浑浊 防止二价铁被氧化 b 85%
【解析】(1). Fe2+易被空气中的O2氧化成Fe3+,实验室配制绿矾溶液时,为防止FeSO4被氧化变质,应加入的试剂为Fe,加入铁粉后,Fe3+可被铁粉还原为Fe2+,且不引入杂质,故答案为:Fe;
(2). Fe2+和HCO3-发生反应生成FeCO3沉淀、CO2和H2O,离子方程式为:Fe2++2HCO3-=FeCO3↓+CO2↑+ H2O,故答案为:Fe2++2HCO3-=FeCO3↓+CO2↑+ H2O;
(3). ①. 检查装置A气密性的方法是:关闭弹簧夹,从长颈漏斗注入一定量的水,使漏斗内的水面高于具支试管中的水面,停止加水一段时间后,若长颈漏斗与具支试管中液面的高度差保持不变,说明装置不漏气,故答案为:关闭弹簧夹,从长颈漏斗注入一定量的水,使漏斗内的水面高于具支试管中的水面,停止加水一段时间后,若长颈漏斗与具支试管中的液面差保持不变,说明装置不漏气;
②. 装置A为固液不加热型制气装置,且具有随开随用、随关随停的特点,所以应选择块状不溶于水的CaCO3,酸只能选择盐酸,若选择硫酸,生成的CaSO4微溶于水,阻碍反应的进行,故答案选:C;
③. 当C中充满CO2后,CO2开始进入D中,使D中的澄清石灰水变浑浊,这时说明C中空气已经排尽,故答案为:D中澄清石灰水变浑浊;
④. 由题中信息可知,柠檬酸具有强还原性,可防止Fe2+被氧化,故答案为:防止二价铁被氧化;
⑤. 因甘氨酸亚铁易溶于水,难溶于乙醇,所以应选择乙醇溶液作为洗涤剂,故答案为:B;
⑥. 含0.10mol FeSO4的绿矾溶液中Fe2+的物质的量为0.10mol,因NH4HCO3溶液过量,所以生成(NH2CH2COO)2Fe的物质的量为0.10mol、质量为20.4g,则产率为:![]() ×100%=85%,故答案为:85%。
×100%=85%,故答案为:85%。


科目:高中化学 来源: 题型:
【题目】下列关于下图所示原电池的说法正确的是( )
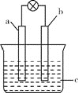
A. 当a为Cu,b为含有碳杂质的Al,c为稀硫酸时,b极上观察不到气泡产生
B. 当a为石墨,b为Fe,c为浓硫酸时,不能产生连续的稳定电流
C. 当a为石墨,b为Cu,c为FeCl3溶液时,a、b之间没有电流通过
D. 当a为Mg,b为Al,c为NaOH溶液时,b极上产生大量气泡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿色化学中,最理想的“原子经济”是原子利用率为100%。下列反应类型最能体现“原子经济性”原则的是
①取代反应 ②加成反应 ③酯化反应 ④水解反应 ⑤加聚反应
A.①②B.③④C.②⑤D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
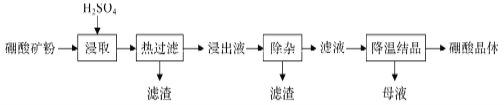
【题目】以硼镁矿(2MgO·B2O3·H2O、SiO2及少量Fe3O4、CaCO3、A12O3)为原料生产硼酸的工艺流程如下:
已知:表一:不同温度下H3BO3的溶解度
温度℃) | 20 | 40 | 60 | 100 |
溶解度(g) | 5.0 | 8.7 | 14.8 | 40.2 |
表二:不同物质沉淀完全时的pH
物质 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
pH | 3.2 | 5.2 | 9.7 | 12.4 |
(1)由于矿粉中含CaCO3,“浸取”时容易产生大量泡沫使物料从反应器中溢出,应采取的措施为_________________________。
(2)“浸出液”显酸性,含有H3BO3、Mg2+和SO42-,还含有Fe2+、Fe3+、Ca2+、Al3+等杂质。“除杂”时,向浸出液中依次加入适量H2O2和MgO,可以除去的杂质离子为_______________________,H2O2的作用为_____________________(用离子方程式表示)。
(3)“浸取”后,采用“热过滤”的目的为__________________________。
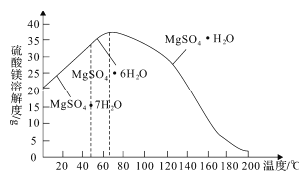
(4)“母液”可用于回收硫酸镁,已知硫酸镁的溶解度随温度变化的曲线如图所示,且溶液的沸点随压强增大而升高。为了从“母液”中充分回收MgSO4·H2O,应采取的措施是将“母液”蒸发浓缩,____________________________________。
(5)己知25℃时,硼酸(H3BO3)溶液中存在如下平衡:H3BO3![]() [B(OH)4]-(aq)+H+(aq);K=5.7×10-10;25℃时,0.7mol·L-1硼酸溶液中c(H+)=__________mol·L-1。
[B(OH)4]-(aq)+H+(aq);K=5.7×10-10;25℃时,0.7mol·L-1硼酸溶液中c(H+)=__________mol·L-1。
(6)已知25℃时:
化学式 | H2CO3 | CH3COOH |
电离常数 | K1=4.4×10-7 K2=4.7×10-11 | K=1.75×10-5 |
下列说法正确的是________(填选项字母)。
a.碳酸钠溶液滴入硼酸溶液中能观察到有气泡产生
b.碳酸钠溶液滴入醋酸溶液中能观察到有气泡产生
c.等浓度碳酸溶液和硼酸溶液的pH:前者>后者
d.等浓度碳酸钠溶液和醋酸钠溶液的pH:前者>后者
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. H2的摩尔质量是2g B. 1mol OH-的质量是17g
C. 摩尔是物质的质量单位 D. 1mol气体所占的体积约为22.4L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.某化学课外活动小组欲检验茶叶中铁元素,设计了如下实验方案:

请回答:
(1)操作①的名称是_____。
(2)加入6mol·L-1的盐酸时为了加快铁元素的浸出速度,可采取的方法有____、_____。
(3)通过血红色溶液不能说明茶叶中的铁元素一定是+3价的,原因是______。
Ⅱ.乙酸乙酯广泛用于药物、染料、香料等工业,甲乙两同学分别设计了如下装置来制备乙酸乙酯,已知:乙酸乙酯的沸点为77.1℃,CH3CH2OH![]() CH2=CH2↑+H2O
CH2=CH2↑+H2O

(1)甲装置中右边导管未插入溶液中的目的是 ______。
(2)实验结束后分离出乙酸乙酯的操作是 ____,必须用到的玻璃仪器有____(选择)。
A.烧杯 B.容量瓶 C.分液漏斗 D.蒸馏烧瓶
(3)乙装置优于甲装置的理由____________(写两条)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知密闭容器中进行的合成氨反应为N2+3H2![]() 2NH3,该反应为放热反应。下列判断正确的是( )
2NH3,该反应为放热反应。下列判断正确的是( )
A. 1 mol N2和3 mol H2的能量之和与2 mol NH3具有的能量相等
B. 反应过程中同时有1.5 mol H—H键、3 mol N—H键断裂时,N2的浓度维持不变
C. 降低NH3的浓度,正反应速率增大,逆反应速率减小
D. 当反应速率满足v(N2)∶v(H2)=1∶3时,反应达到最大限度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com