
| A. | 晶体中,若含有阳离子就一定有阴离子 | |
| B. | 熔点高低:金刚石>食盐>金属钠>冰 | |
| C. | 原子晶体的熔点一定比金属晶体的高 | |
| D. | 在金刚石晶体中,最小的环上的碳原子个数;在石墨晶体的片层结构中,最小的环上的碳原子个数;在NaCI晶体中,与一个Na+最近的且距离相等的CI-的个数,这三个数值均为6. |
分析 A、金属晶体中有阳离子,但没有阴离子;
B、一般来说,晶体熔沸点:原子晶体>离子晶体>分子晶体,金属晶体熔沸点差别较大;
C、金属晶体的熔点差别很大,有的金属晶体熔点很高;
D、金刚石晶体中,最小的环上有6个碳原子;石墨晶体的片层结构中,最小环上的碳原子个数为6个;在NaCI晶体中,一个Na+周围有6个Cl-;
解答 解:A、金属晶体是由金属阳离子和自由电子形成的晶体,晶体中有阳离子,但没有阴离子,故A错误;
B、金刚石是原子晶体,食盐是离子晶体,冰是分子晶体,金属钠是金属晶体,通常条件钠是固体,水是液体,金属钠熔点比较低,所以熔点金刚石>食盐>金属钠>冰,故B正确;
C、金属晶体的熔点差别很大,有的金属晶体熔点很高,如钨熔点三千多度,比一些原子晶体的熔点都高,故C错误;
D、金刚石晶体中,最小的环上的碳原子个数有6个,石墨晶体的片层结构中,最小环上的碳原子个数为6个,NaCl晶体属面心立方结构,与一个Na+最近且距离相等的Cl-的个数有6个,故D正确;
故选:BD.
点评 本题考查了晶体的构成和性质,涉及晶体中微粒间的作用力、晶体的物理性质、晶体的构成等,题目难度不大.


科目:高中化学 来源: 题型:选择题
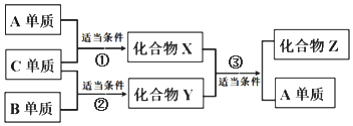 原子序数依次增大的短周期元素A、B、C、D分别位于不同的主族且只有一种金属,D的单质可与热水发生置换反应,所得溶液只能使酚酞变为浅红色;X、Y、Z是由A、B、C组成的二元化合物,其中X常温为液体,且Z可用于配制碳酸饮料.它们之间有如下转化关系,(①②条件为点燃,③为高温、催化剂)下列说法不正确的是( )
原子序数依次增大的短周期元素A、B、C、D分别位于不同的主族且只有一种金属,D的单质可与热水发生置换反应,所得溶液只能使酚酞变为浅红色;X、Y、Z是由A、B、C组成的二元化合物,其中X常温为液体,且Z可用于配制碳酸饮料.它们之间有如下转化关系,(①②条件为点燃,③为高温、催化剂)下列说法不正确的是( )| A. | D单质着火不可以用泡沫灭火器灭火 | |
| B. | 化合物Y和Z均为空气质量日报的主要污染物 | |
| C. | 原予半径:D>B>C>A | |
| D. | 化合物W化学式为B2A4,在一定条件下W可以与X发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 7.2 g CaO2晶体中阴离子和阳离子总数为0.3 NA | |
| B. | 在标况下,22.4LHF和22.4LC2H4原子个数比为1:3 | |
| C. | 6.0gSiO2晶体中含有0.4NA个Si-O键 | |
| D. | 1molMg在空气中完全燃烧生成MgO和Mg3N2,转移的电子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若某反应的生成物总能量低于反应物总能量,则该反应为吸热反应 | |
| B. | 若A2+2D-=2A-+D2,则氧化性:D2>A2 | |
| C. | 若R2-和M+的电子层结构相同,则原子序数:R>M | |
| D. | 若甲、乙两种有机物具有相同的分子式,不同的结构,则甲和乙一定是同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在相同条件下pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,水的电离程度前者比后者大 | |
| B. | 反应NH3(g)+HCl(g)?NH4Cl(s)能自发进行,则该反应△H>0 | |
| C. | 锌与稀硫酸反应时加入少量硫酸铜,反应加快的主要原因是Cu2+水解增大了c(H+) | |
| D. | 一定条件下,反应2SO2(g)+O2(g)?2SO3(g)△H<0达到平衡后,升高体系温度,反应重新达到平衡前,有2v正(O2)<v逆(SO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ≡C-CH3的分子结构,下列说法正确的是( )
≡C-CH3的分子结构,下列说法正确的是( )| A. | 除苯环外的其余碳原子有可能都在一条直线上 | |
| B. | 除苯环外的其余碳原子不可能都在一条直线上 | |
| C. | 12个碳原子不可能都在同一平面上 | |
| D. | 所有原子有可能都在同一平面上 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 14 g分子式为CnH2n的烃中含有的C-H键的数目为2NA | |
| B. | 2.24 L(标准状况)甲烷与7.1 g氯气在光照条件下反应得到CH3Cl的分子数为0.1NA | |
| C. | 含有10.7 g Fe(OH)3的氢氧化铁胶体中,氢氧化铁胶粒总数为0.1NA | |
| D. | 100g 17%的氨水,溶液中含有的NH3分子数为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com