
【题目】已知723K时,2SO2(g)+O2(g)![]() 2SO3(g)△H=﹣QkJ/mol,在相同条件下,向一密闭容器中通入2mol SO2和1mol O2,达到平衡时放出的热量为Q1kJ;向另一体积相同的密闭容器中通入1mol SO2和0.5mol O2,达到平衡时放出的热量为Q2kJ。则Q1、Q2、Q满足的关系是( )
2SO3(g)△H=﹣QkJ/mol,在相同条件下,向一密闭容器中通入2mol SO2和1mol O2,达到平衡时放出的热量为Q1kJ;向另一体积相同的密闭容器中通入1mol SO2和0.5mol O2,达到平衡时放出的热量为Q2kJ。则Q1、Q2、Q满足的关系是( )
A.Q2=![]() B.Q2>
B.Q2>![]() C.Q2<Q1<Q D.Q=Q1>Q2
C.Q2<Q1<Q D.Q=Q1>Q2
 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、W五种短周期元素。X原子的质子数与电子层数相同,W原子核外电子数是M原子最外层电子数的2倍,Y、Z、M、W在周期表中的相对位置如图所示。下列说法不正确的是

A. 原子半径:W>Y>Z>M>X
B. 热稳定性:XM>X2Z
C. 仅由X、Y、Z三种元素形成的化合物中不可能含离子键
D. WM4分子中每个原子最外层均满足8电子结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物A(仅含三种元素,摩尔质量为198g·mol-1)具有高效的消毒作用,是一种新型非氮高效消毒剂。为探究化合物A的组成与性质,设计并完成以下实验:取3. 96g化合物A溶于水中,一段时间后全部转化为B(红褐色沉淀)、C(一种碱)和气体单质D(可使带火星的木条复燃),向溶液中加入100mL 0.6mol/L稀硫酸,再加入含有0.08mol KOH的溶液,恰好完全反应。过滤,将沉淀洗涤后充分灼烧,得到红棕色固体粉末1.60g。将所得溶液在一定条件下蒸发可得到一种纯净的不含结晶水的盐。
(1)化合物A所含有的元素:_______________(用元素符号表示)。
(2)化合物A与H2O反应的离子方程式:__________________。
(3)化合物A可由FeCl3和KClO在强碱性条件下制得,其反应的离子方程式:_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,在一体积固定的密闭容器中加入2 mol X和1 mol Y,发生如下反应:2X(g)+Y(g) ![]() a Z(g)+W(g) ΔH=-Q kJ·mol-1(Q>0)。当反应达到平衡后,反应放出的热量为Q1 kJ,物质X的转化率为α;平衡后再升高温度,混合气体的平均相对分子质量减小,则
a Z(g)+W(g) ΔH=-Q kJ·mol-1(Q>0)。当反应达到平衡后,反应放出的热量为Q1 kJ,物质X的转化率为α;平衡后再升高温度,混合气体的平均相对分子质量减小,则
(1)温度升高,平衡常数K的值是____________(填“增大”、“减小”或“不变”)。
(2)化学计量数a的值为____________。
(3)有同学认为,Q1一定小于Q,你认为该结论是否正确?________,其理由是___________________。
(4)维持温度不变,若起始时向容器中加入的物质的量如下列各项,则反应达到平衡后放出的热量仍为Q1 kJ的是____________(稀有气体不参与反应)。
A.2 mol X、1 mol Y、1 mol Ar
B.a mol Z、1 mol W
C.1 mol X、0.5 mol Y、0.5a mol Z、0.5 mol W
D.2 mol X、1 mol Y、1 mol Z
(5)X的转化率α=____________(用含Q、Q1的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的。如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化,下列说法中正确的是

A. 1 mol N2(g)和1 mol O2(g)反应放出的能量为180 kJ
B. NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水
C. 在1 L的容器中发生反应,10 min内 N2减少了1 mol,因此10 min内的平均反应速率为v(NO)=0.1 mol·![]()
![]()
D. 1 mol N2(g)和1 mol O2(g)具有的总能量小于2 mol NO(g)具有的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.碳﹣12 原子和碳﹣13 原子的中子数相同
B.KMnO4 和 K2 MnO4 中有相同的原子团
C.Fe2+和 Fe3+都属于铁元素,核外电子数不同
D. 和
和 化学性质相似
化学性质相似
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知pCa=-lgc(Ca2+),Ksp(CaSO4)=9.0×10-6,Ksp(CaCO3)=2.8×10-9,向10 mL CaCl2溶液中滴加0.1mol/L的Na2SO4溶液时,溶液中pCa与Na2SO4溶液体积(V)的关系如图所示(实线),下列有关说法正确的是(已知1g3=0.48)
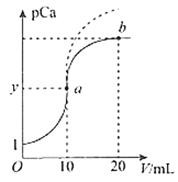
A. y值为3.48
B. a与b两点c(Ca2+)之比为50:3
C. 原CaCl2溶液浓度为1mol/L
D. 若把0.1mol/L的Na2SO4溶液换成0.1mol/L的Na2CO3溶液则图象在终点后变为虚线部分
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F为原子序数依次增大第三周期元素。已知A、C、F三原子的最外层共有11个电子,且这种三元素的最高价氧化物的水化物之间两两皆能反应,均能生成盐和水,D元素原子的最外层电子数比次外层电子数少4个,E元素氢化物中有2个氢原子,试回答:
(1)写出B原子结构示意图___
(2)元素最高价氧化物对应水化物中碱性最强的是___,写出一种含有F元素的具有漂白性的物质___(用化学式表示)。
(3)用电子式表示A、F原子形成化合物的过程___。
(4)C、F两种元素最高价氧化物的水化物之间反应的离子方程式___。
(5)设计实验证明E、F两种元素非金属性的强弱___(化学方程式加必要文字说明)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com