
| A. | 第一电离能由大到小的顺序为O>N>C | |
| B. | NO3-中N采用sp2杂化,故NO3-的空间构型为三角锥形 | |
| C. | 由于C22-和O22+为等电子体,所以可以判断O22+的电子式为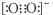 | |
| D. | 液态HF通常也可以写成(HF)n的形式,是因为液态HF分子间存在氢键 |
分析 A.同周期从左到右,第一电离能增大,但同周期第ⅡA、ⅤA元素反常;
B.NO3-中N采用sp2杂化,且无弧对电子对;
C.C22-和O22+两种微粒,原子数相同,价电子总数相等互为等电子体;
D.液体HF分子间若形成氢键,有可能发生缔合现象.
解答 解:A.同周期从左到右,第一电离能增大,但同周期第ⅡA、ⅤA元素最外层电子达到全充满或半充满,结构稳定,所以第一电离能由大到小的顺序为N>O>C,故A错误;
B.NO3-中N采用sp2杂化,中心原子周围无弧对电子对,所以空间构型为平面三角形,故B错误;
C.C22-和O22+两种微粒,原子数相同,价电子总数相等互为等电子体,结构相似,电子式为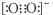 ,故C正确;
,故C正确;
D.F的非金属性较强,液体HF分子间若形成氢键,有可能发生缔合现象,故D正确.
故选CD.
点评 本题主要考查较为综合,涉及电离能、等电子体、晶格能、氢键等知识,为高考常见题型,侧重于基本概念的理解,注意掌握相关的概念内涵,B选项等电子体的结构相似是该题的易错点,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题

| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 溶解性 | |
| 环己醇 | 100 | 0.961 8 | 161 | 微溶于水 |
| 环己烯 | 82 | 0.810 2 | 83 | 难溶于水 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
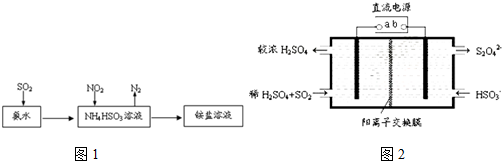
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
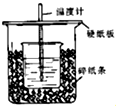 50ml0.50mol/L盐酸和50ml0.55mol/LNaOH溶液在如下图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热,回答下列问题:
50ml0.50mol/L盐酸和50ml0.55mol/LNaOH溶液在如下图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增大压强,化学平衡不一定发生移动 | |
| B. | 通入与反应无关的氦气,化学平衡不发生移动 | |
| C. | 增大X或Y的物质的量,化学平衡一定发生移动 | |
| D. | 其它条件不变,升高温度,化学平衡一定发生移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度和增大压强都有利于平衡向生成氨的方向移动 | |
| B. | 298K时合成氨反应不能自发进行 | |
| C. | 298K时合成氨的反应速率一定很大 | |
| D. | 298K时合成氨反应可自发进行 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com