
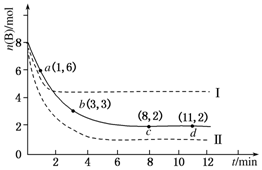
���� ��1����ѧ��Ӧƽ����Ӧ����=$\frac{��c}{��t}$���������ߵ�б��Խ�õ㷴Ӧ����Խ��ͬһ���淴Ӧ��ͬһ��ʱ���ڸ����ʵķ�Ӧ����֮�ȵ����������֮�ȣ��ݴ��жϣ�
��2����ƽ��������Ӧ�����ƶ�ʱ������Ӧ���ʴ����淴Ӧ���ʣ�
��3����Ӧǰn��B��=8mol��ƽ��ʱn��B��=2mol����μӷ�Ӧ��n��B��=8mol-2mol=6mol��ת����=$\frac{�μӷ�Ӧ��n��B��}{��ʼn��B��}$��
���ݷ���ʽ֪���μӷ�Ӧ��n��A��=$\frac{1}{3}$��6mol=2mol�����ɵ�n��C��=n��D��=n��A�����μӷ�Ӧ�ģ�=2mol��
ƽ��ʱc��A��=$\frac{6mol-2mol}{2L}$=2mol/L��c��B��=c��C��=c��D��=$\frac{2mol}{2L}$=1mol/L��
��ѧƽ�ⳣ��K����������Ũ����֮���뷴Ӧ��Ũ����֮���ıȣ�
��4�����ߢ�ﵽƽ������ʱ�����̣�˵����Ӧ��������ƽ��ʱB�ĺ�������ƽ�������ƶ���
���ߢ�ﵽƽ������ʱ�����̣�˵����Ӧ��������ƽ��ʱB�ĺ�����С��ƽ�������ƶ���
��� �⣺��1����ѧ��Ӧƽ����Ӧ����=$\frac{��c}{��t}$���������ߵ�б��Խ�õ㷴Ӧ����Խ��ͬһ���淴Ӧ��ͬһ��ʱ���ڸ����ʵķ�Ӧ����֮�ȵ����������֮�ȣ�����ͼ��֪��б��������A����С����D�����Է�Ӧ����������A����С����D���ʴ�Ϊ��A��D��
��2����ƽ��������Ӧ�����ƶ�ʱ������Ӧ���ʴ����淴Ӧ���ʣ�����ͼ֪��b���B�����ʵ�����С��˵��ƽ�������ƶ���������Ӧ���ʴ����淴Ӧ���ʣ��ʴ�Ϊ�����ڣ�
��3����Ӧǰn��B��=8mol��ƽ��ʱn��B��=2mol����μӷ�Ӧ��n��B��=8mol-2mol=6mol��ת����=$\frac{�μӷ�Ӧ��n��B��}{��ʼn��B��}$=$\frac{6mol}{8mol}��100%$=75%��
���ݷ���ʽ֪���μӷ�Ӧ��n��A��=$\frac{1}{3}$��6mol=2mol�����ɵ�n��C��=n��D��=n��A�����μӷ�Ӧ�ģ�=2mol��
ƽ��ʱc��A��=$\frac{6mol-2mol}{2L}$=2mol/L��c��B��=c��C��=c��D��=$\frac{2mol}{2L}$=1mol/L��
��ѧƽ�ⳣ��K����������Ũ����֮���뷴Ӧ��Ũ����֮���ı�=$\frac{1��1}{1��2}$=0.5��
�ʴ�Ϊ��75%��0.5��
��4�����ߢ�ﵽƽ������ʱ�����̣�˵����Ӧ��������ƽ��ʱB�ĺ�������ƽ�������ƶ����÷�Ӧ������Ӧ�Ƿ��ȷ�Ӧ�����Ըı�������������¶ȣ�
���ߢ�ﵽƽ������ʱ�����̣�˵����Ӧ��������ƽ��ʱB�ĺ�����С��ƽ�������ƶ����÷�Ӧ������Ӧ�Ƿ��ȵ����������С�ķ�Ӧ�����Ըı������������ѹǿ��
�ʴ�Ϊ�������¶ȣ�����ѹǿ��
���� ���⿼�黯ѧƽ���йؼ��㣬Ϊ��Ƶ���㣬���ؿ���ѧ���������жϼ�������������ȷ��ȡͼ����Ϣ�����������Ϣ��������ǽⱾ��ؼ���ע�⻯ѧƽ�ⳣ������ʱҪ�á�ƽ��ʱ������Ũ�ȡ����������������1ʱҲ�����á�ƽ��ʱ�����ʵ����ʵ��������㣬��Ŀ�ѶȲ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ƶ���
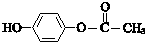
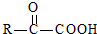 $\stackrel{һ������}{��}$
$\stackrel{һ������}{��}$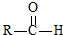 +H2O
+H2O $��_{��}^{NaOH��aq��}$
$��_{��}^{NaOH��aq��}$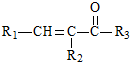 +H2O
+H2O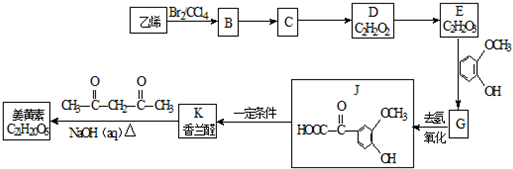
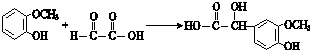 ��
��
 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
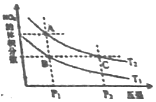 ��ӦN2O4��g��?2NO2��g����H��0�����¶ȷֱ�ΪT1��T2ʱ��ƽ����ϵ��NO2�����������ѹǿ�仯������ͼ��ʾ������˵����ȷ���ǣ�������
��ӦN2O4��g��?2NO2��g����H��0�����¶ȷֱ�ΪT1��T2ʱ��ƽ����ϵ��NO2�����������ѹǿ�仯������ͼ��ʾ������˵����ȷ���ǣ�������| A�� | A��C����ķ�Ӧ���ʣ�A��C | |
| B�� | A��C����Ļ�ѧƽ�ⳣ����A��C | |
| C�� | A��C����N2O4��ת���ʣ�A��C | |
| D�� | ��״̬B��״̬A�������ü��ȵķ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ʱ��/min | n��SO2��/mol | n��O2��/mol |
| 0 | 0.10 | 0.050 |
| 4 | 0.050 | 0.025 |
| 5 | 0.040 | |
| 8 | 0.020 |
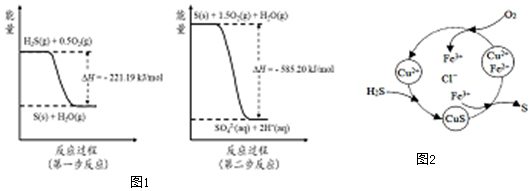
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Ũ��������м��Ӧ��2Fe+6H+�T2Fe3++3H2�� | |
| B�� | NaHCO3��Һ��ϡH2SO4��Ӧ��CO32-+2H+�TH2O+CO2�� | |
| C�� | ��������ͭ�еμ�ϡ���Cu��OH��2+2H+�TCu2++2H2O | |
| D�� | п����ϡ���ᷴӦ��Zn+2H+�TZn2++H2�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���ü������ɸ��������Һ�ķ�����ø�����ؾ��� | |
| B�� | ����ʱ��Ϊ�˼ӿ�������ʣ����ò�������©���ڽ��� | |
| C�� | ����ȴ�ᾧ���ᴿ���������Ȼ������ʵ�����ع��� | |
| D�� | ij��ɫ��Һ�м���ϡ�����������ټ�Ba��NO3��2��Һ��������ɫ��������ԭ��Һ��һ����SO42- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | NaHCO3��Һ | B�� | NaHSO3��Һ | C�� | CH3COONa��Һ | D�� | Na2HPO4��Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ڶƼ��ϵ��п����п������ | |
| B�� | ��ⷨ������ͭ���ô�ͭ������ | |
| C�� | ��ⱥ��ʳ��ˮ����������Ϳ��̼���������� | |
| D�� | ������ڵ���������ȡ������������������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �٢ڢ� | B�� | .�٢ڢ� | C�� | �ڢۢ� | D�� | ȫ����ȷ |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com