
(1)(19分)①研究性学习小组为了证明铁的金属性比铜强,他设计了如下几种方案,其中合理的是 (填序号)
A.铁片置于硫酸铜溶液中有铜析出;
B.铁、铜与氯气反应分别生成FeCl3、CuCl2;
C.铜片置于FeCl3溶液中,铜片逐渐溶解(2FeCl3+Cu=2FeCl2+ CuCl2)
D.铁片、铜片分别置于盛有稀硫酸的烧杯中,铁片上有气泡产生,而铜片无气泡
E.常温下,分别将铁片和铜片置于浓硝酸中,铁片不溶解,而铜片溶解
②请你另设计一个能证明铁的金属活动性比铜强的实验。要求:
a.此方案的原理不同于上述任一合理方案;
b.在方框内绘出实验装置图并注明所需的药品;
c.写出实验过程中的主要实验现象并用相关化学用语解释现象

(2)学完原电池的相关知识后,甲组同学认为构成原电池必须有三个条件:①活动性不同的两极;②电解质溶液;③闭合回路。乙组同学对条件①提出异议,认为相同的两极也可以构成原电池,以下为乙组同学的实验装置简图以及实验报告的部分内容。请仔细阅读实验报告,然后将实验报告补充完整并填在相应的横线上。装置中盐桥的作用之一是使整个装置构成闭合回路。

浓差电池与温差电池
一、【实验目的】
1、电池中两杯溶液及电极均相同,两杯溶液的浓度不同,可否形成原电池
2、电池中两杯溶液及电极均相同,两杯溶液的温度不同,可否形成原电池
3、电池中两杯溶液及电极均相同,研究两杯溶液的 对电池电压和电流的影响
4、电池中两杯溶液及电极均相同,研究两杯溶液的 对电池电压和电流的影响
二、【仪器与药品】略。
三、【实验方法与步骤】
Ⅰ、实验方法:略。
Ⅱ、研究的步骤
㈠实验A:浓差电池
电解液均为硫酸铜,电极均为铜片:
1、甲烧杯中固定装入浓度 0.8 mol/L 的硫酸铜溶液。
2、乙烧杯中分別装入浓度 0.8 mol/L、0.4 mol/L 、0.2 mol/L、0.1 mol/L、0.05 mol/L、0.025 mol/L 的硫酸铜溶液。
3、使用铜片当电极。测量这六种组合电池的稳定电压及电流,将结果记录于表 1。
㈡实验B:温差电池
电解液均为硫酸铜,电极均为铜片:(步骤略,结果记录于表2)
四、【实验结果】
实验A:浓差电池 :表1
|
甲杯硫酸铜浓度 mol/L |
0.8 |
0.8 |
0.8 |
0.8 |
0.8 |
0.8 |
|
乙杯硫酸铜浓度 mol/L |
0.8 |
0.4 |
0.2 |
0.1 |
0.05 |
0.025 |
|
两杯溶液浓度差值 |
0 |
0.4 |
0.6 |
0.7 |
0.75 |
0.775 |
|
电压 mV |
0 |
6 |
12 |
16 |
22 |
26 |
|
电流 mA |
0 |
0.02 |
0.04 |
0.06 |
0.07 |
0.08 |
实验B:温差电池:表2
|
甲杯硫酸铜温度℃ |
19 |
19 |
19 |
19 |
19 |
19 |
|
乙杯硫酸铜温度℃ |
19 |
29 |
39 |
49 |
59 |
69 |
|
两杯溶液温差℃ |
0 |
10 |
20 |
30 |
40 |
50 |
|
电压 mV |
0 |
6.1 |
12 |
20[来源:] |
27 |
34 |
|
电流 mA |
0 |
0.025 |
0.047 |
0.07 |
0.15 |
0.18 |
五、【讨论】
1、浓差电池:若硫酸铜浓差电池放电较长一段时间后,可观察到甲杯高浓度的溶液颜色逐渐变浅,而乙杯颜色变深,而电压也逐渐下降,同时可观察到甲杯中铜片表面有铜析出。
这说明:甲杯中的电极反应式为
乙杯中的电极反应式为
电池放电一段较长时间后电压下降的原因:
2、温差电池(略)
六、【结论】
由上述【实验结果】可得结论:
实验A: [来源:学&科&网Z&X&X&K]
实验B:(略)
甲、乙两小组同学给你什么启示:
(1)
①AD(2分)
② 图
图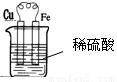 (2分,其他合理答案亦可)
(2分,其他合理答案亦可)
现象:铜片表面有气泡;(1分)解释:2H++2e-=H2↑(2分)
现象:铁片逐渐溶解;(1分) 解释:Fe-2e-=Fe2+ (2分)(其他合理答案亦可)
(2)(共9分)
一、1、浓度差; 2、温度差 ( 或1、温度差 2、浓度差) (各1分)
(没“差”字,不得分)
五、Cu2++2e-=Cu Cu-2e-=Cu2+ (各2分) 两杯溶液浓度差变小(1分)
六、实验A结论:
两杯溶液及电极均相同,两杯溶液浓度差越大,浓差电池的电流、电压越大;(1分)
两杯溶液及电极均相同,两杯溶液浓度不同,即可形成浓差电池等其他合理答案亦可
启示:敢于质疑,勇于探究(其他合理答案亦可)(1分)
【解析】


科目:高中化学 来源: 题型:阅读理解
过氧乙酸 本品包括甲、乙两种溶液,体积各500 mL,把甲、乙溶液各1份在玻璃容器中混合后放置24小时后,其中过氧乙酸浓度小少于10%,应用50倍纯水稀释(浓度为0.2%),稀释后才能使用。 |
有关资料:H2O2是极弱的电解质,在酸性介质中才能稳定存在,是一种强氧化剂。过氧乙酸消毒液是由H2O2、H2O、CH3COOH及少量H2S4O混合后,反应生成过氧乙酸(CH3COOOH),反应的化学方程式:CH3COOH+H2O2![]() CH3COOOH+H2O。CH3COOOH容易放出氧原子,它与空气中微生物机体作用,达到灭菌目的,是消毒液的主要成分。
CH3COOOH+H2O。CH3COOOH容易放出氧原子,它与空气中微生物机体作用,达到灭菌目的,是消毒液的主要成分。
(1)某研究性学习小组为了弄清配制过氧乙酸消毒液的甲、乙溶液的主要成分各是什么?进行以下科学探究,请你完成下列相关内容:
①提出假设:甲溶液的主要成分为_________,乙溶液的主要成分为_________。
②实验验证:取甲、乙两种溶液少许,分别加入几滴_________试液,甲溶液的现象为_________,乙溶液的现象为______________________________________________________。
③得出结论:甲溶液的主要成分为_________,乙溶液的主要成分为_________。
(2)有关过氧乙酸的叙述正确的是_________ (填编号)
A.过氧乙酸与羟基乙酸(HOCH2COOH)互为同分异构体
B.过氧乙酸与苯酚混合使用可增强消毒效果
C.过氧乙酸与乙酸属于同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
(10分) (1)某研究性学习小组对“钠在空气中燃烧的产物”进行了探究。其实验过程是:取一小块钠在空气中加热片刻后与一定量的水反应,收集到VmL气体(标准状况),向所得溶液中滴入1.000mol/L的盐酸溶液30.00mL恰好中和完全(如图所示)。试回答:
①甲、乙、丙三套装置共有________处错误。
②丙的操作中,若以酚酞作指示剂,滴定终点时锥形瓶内溶液颜色变化是 。
③若V=168mL(标准状况),在一定条件下将其引燃,恰好完全反应。请将钠块在空气中加热片刻后所得到的固体成分及其质量填表如下:(表格可不填满也可补充)
| 成分 |
|
|
|
| 质量/g |
|
|
|
(2)其实滴定的方法有多种,除上述实验中的酸碱中和滴定外,还有沉淀滴定、络合滴定等。沉淀滴定所用的指示剂本身就是一种沉淀剂,滴定剂和被滴定物的生成物的溶解度要比滴定剂和指示剂生成物的溶解度_____(填“大”、“小”、“相同”),否则不能用这种指示剂。如用AgNO3溶液滴定溶液中的Cl-的含量时常以CrO42-为指示剂,这是因为AgCl比Ag2CrO4更____溶的缘故。
查看答案和解析>>
科目:高中化学 来源:2010—2011学年高二年级高考复习方案配套课标版(二)月考化学试卷 题型:实验题
(10分) (1)某研究性学习小组对“钠在空气中燃烧的产物”进行了探究。其实验过程是:取一小块钠在空气中加热片刻后与一定量的水反应,收集到VmL气体(标准状况),向所得溶液中滴入1.000mol/L的盐酸溶液30.00mL恰好中和完全(如图所示)。试回答:
①甲、乙、丙三套装置共有________处错误。
②丙的操作中,若以酚酞作指示剂,滴定终点时锥形瓶内溶液颜色变化是 。
③若V=168mL(标准状况),在一定条件下将其引燃,恰好完全反应。请将钠块在空气中加热片刻后所得到的固体成分及其质量填表如下:(表格可不填满也可补充)
| 成分 | | | |
| 质量/g | | | |
 __(填“大”、“小”、“相同”),否则不能用这种指示剂。如用AgNO3溶液滴定溶液中的Cl-的含量时常以CrO42-为指示剂,这是因为AgCl比Ag2CrO4更____溶的缘故。
__(填“大”、“小”、“相同”),否则不能用这种指示剂。如用AgNO3溶液滴定溶液中的Cl-的含量时常以CrO42-为指示剂,这是因为AgCl比Ag2CrO4更____溶的缘故。查看答案和解析>>
科目:高中化学 来源:2010年广东省汕头市潮阳一中理综化学考前押题卷 题型:实验题
向0.1mol/L的草酸(H2C2O4)溶液中逐滴加入酸性高锰酸钾溶液时,溶液褪色总是先慢后快。对其原因,某研究性学习小组结合化学反应原理提出猜想与假设,并设计了一系列实验进行探究:
| 实验组别 | 试管标号 | 所加药品 | 实验现象 (褪色时间) |
| 一 (室温) | 1 | 10ml 0.1mol/L的草酸(H2C2O4)溶液(用少量硫酸酸化)0.1mol/L的KMnO4溶液适量 + 少量硫酸锰固体 | 2s |
| 2 | 10ml 0.1mol/L的草酸(H2C2O4)溶液(用少量硫酸酸化)0.1mol/L的KMnO4溶液适量 | 30s | |
| 二 (室温) | 1 | 5ml 0.1mol/L的草酸(H2C2O4)溶液 5滴0.1mol/L的KMnO4溶液+10滴稀硫酸 | 90s |
| 2 | 5ml 0.1mol/L的草酸(H2C2O4)溶液 5滴0.1mol/L的KMnO4溶液 | 100s | |
| 三 (65℃ 的水浴) | 1 | 5ml 0.1mol/L的草酸(H2C2O4)溶液 5滴0.1mol/L的 KMnO4溶液 +10滴稀硫酸 | 90s |
| 2 | 5ml 0.1mol/L的草酸(H2C2O4)溶液 5滴0.1mol/L的KMnO4溶液 +1ml稀硫酸 | 100s | |
| 3 | 5ml 0.1mol/L的草酸(H2C2O4)溶液 5滴0.1mol/L的KMnO4溶液 +2ml稀硫酸 | 120s |
查看答案和解析>>
科目:高中化学 来源:2012届高二年级高考复习方案配套课标版(二)月考化学试卷 题型:实验题
(10分) (1)某研究性学习小组对“钠在空气中燃烧的产物”进行了探究。其实验过程是:取一小块钠在空气中加热片刻后与一定量的水反应,收集到VmL气体(标准状况),向所得溶液中滴入1.000mol/L的盐酸溶液30.00mL恰好中和完全(如图所示)。试回答:

①甲、乙、丙三套装置共有________处错误。
②丙的操作中,若以酚酞作指示剂,滴定终点时锥形瓶内溶液颜色变化是 。
③若V=168mL(标准状况),在一定条件下将其引燃,恰好完全反应。请将钠块在空气中加热片刻后所得到的固体成分及其质量填表如下:(表格可不填满也可补充)
|
成分 |
|
|
|
|
质量/g |
|
|
|
(2)其实滴定的方法有多种,除上述实验中的酸碱中和滴定外,还有沉淀滴定、络合滴定等。沉淀滴定所用的指示剂本身就是一种沉淀剂,滴定剂和被滴定物的生成物的溶解度要比滴定剂和指示剂生成物的溶解度_____(填“大”、“小”、“相同”),否则不能用这种指示剂。如用AgNO3溶液滴定溶液中的Cl-的含量时常以CrO42-为指示剂,这是因为AgCl比Ag2CrO4更____溶的缘故。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com