
����Ŀ����ҵ�����Ȼ�隣������̿��Ʊ��ߴ�̼���̵�������ͼ��ʾ��

��֪�������̿����Ҫ�ɷ���MnCO3������ΪFe��Ca��Mg��Al��Ԫ�ء�
�ڲ��������ӳ���ʱ��Һ��pH��
���� | Al3+ | Fe3+ | Ca2+ | Mn2+ | Mg2+ |
��ʼ������pH | 4.1 | 2.2 | 10.6 | 8.1 | 9.1 |
������ȫ��pH | 4.7 | 3.2 | 13.1 | 10.1 | 11.1 |
�۱��չ�������Ҫ��ӦΪMnCO3+2NH4Cl![]() MnCl2+2NH3��+CO2��+H2O��
MnCl2+2NH3��+CO2��+H2O��
��1�������ͼ1��2��3���������չ�������ѵı����¶ȡ�����ʱ�䡢![]() �ֱ�Ϊ___��___��___��
�ֱ�Ϊ___��___��___��
|
|
|
��ͼ1�����¶ȶ��̽����ʵ�Ӱ�� | ��ͼ2����ʱ�����̽����ʵĹ�ϵ | ��ͼ3�Ȼ�������̿�������ȶ��̽����ʵ�Ӱ�� |
��2���Խ���Һ��������ʱ�����ȼ���MnO2��������____���ٵ�����ҺpH�ķ�ΧΪ___����Fe3+��Al3+��Ϊ��������ȥ��Ȼ�����NH4F��Ca2+��Mg2+��Ϊ�����������ȥ��
��3�����������п�ѭ��ʹ�õ�������_____���ѧʽ����
��4�����õζ����ⶨ��Ʒ���̵ĺ�����ʵ�鲽�裺��ȡ4.000g�����������м����Թ�������������ᣬ����ʹ��Ʒ�е�MnCO2��ȫת��Ϊ[Mn(PO4)2]3-������NO3-ת��ΪNO2-���������Թ���������泥�������ӦNO2-+NH4+�TN2��+2H2O�Գ�ȥNO2-������ϡ�����ữ����60.00mL0.50mol��L-1��������隣���Һ���еζ��������ķ�ӦΪ[Mn(PO4)2]3-+Fe2+�TMn2++Fe3++2PO43-����5.00mL0.50mol��L-1����K2Cr2O7��Һǡ�ó�ȥ������Fe2+��
������K2Cr2O7��Һ��Fe2+��Ӧ�����ӷ���ʽΪ_______��
���������̵���������Ϊ____��
���𰸡�500�� 60min 1.10 ��Fe2+����ΪFe3+ 4.7��pH<8.1 NH4Cl 6Fe2++Cr2O72-+14H+�T6Fe3++2Cr3++7H2O 20.625%
��������
������Ϣ����þ������Ҫ�ɷ���MnCO3��������Fe��Ca��Mg��Al��Ԫ�أ��ڼ����Ȼ�狀��գ�Ȼ���������Ҫ�õ�MnCl2��������Fe��Ca��Mg��Al��Ԫ�ص����ʣ��������ӣ�������Ϣ��ȷ�ϳ�ȥ��ЩԪ�أ�̼���ᾧ�У�����Mn2����2HCO3��=MnCO3����CO2����H2O�������ˡ�ϴ�ӡ�����õ�̼���̲�Ʒ��
��1��ͼ1�̵Ľ��������¶ȵ����߶�����500���Ժ�����仯������ѱ����¶�Ϊ500�棻����ͼ2������ʱ�������̵Ľ���������60min������仯������˱���ʱ�����Ϊ60min��ͬ������Ȼ�������̿������ı�ֵΪ1.10��
��2���������̿��еijɷ֣������õ�Mn2�����Լ�����Fe��Ca��Mg��Al��Ԫ�أ����ݲ��������ӳ���ʱ��Һ��pH���Խ���Һ�������ӣ��ȼ�MnO2������MnO2�������ԣ���Fe2��������Fe3��������ͨ������pH����ȥ������pH����ȥ����Fe3����Al3��������ʹMn2����������˵���pH�ķ�Χ��4.7��pH<8.1��
��3���������̣�NH4Cl����ѭ��ʹ�ã�
��4��������K2Cr2O7��ǿ�����Խ�Fe2�������������ӷ�Ӧ����ʽΪ6Fe2��+Cr2O72��+14H����6Fe3��+2Cr3��+7H2O��
�ڸ������⣬������ϵʽΪ6MnCO3��6[Mn(PO4)2]3����6Fe2����������Fe2����K2Cr2O7�ζ��������[Mn(PO4)2]3����Ӧ��Fe2�����ʵ���Ϊ(60��10��3 L��0.5mol��L��1��5��10��3 L��0.5mol��L��1��6)�����ݹ�ϵʽ���Ƴ�MnԪ�ص�����Ϊ(60��10��3 L��0.5mol��L��1��5��10��3 L��0.5mol��L��1��6)��55g��mol��1����MnԪ�ص���������Ϊ(60��10��3 L��0.5mol��L��1��5��10��3 L��0.5mol��L��1��6)��55g��mol��1/4.000g��100%=20.625%��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ӦC��s��+H2O��g��![]() CO��g��+H2��g����һ�ɱ��ݻ����ܱ������н��У����������ĸı���䷴Ӧ���ʼ�����Ӱ�����(����)
CO��g��+H2��g����һ�ɱ��ݻ����ܱ������н��У����������ĸı���䷴Ӧ���ʼ�����Ӱ�����(����)
A. ʹ������䣬����H2O���� B. �������������Сһ��
C. ʹ������䣬�交��ʹ��ϵѹǿ���� D. ʹѹǿ���䣬�交��ʹ�����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪����Ӧ����I2(aq)+I-(aq)![]() I3-(aq) ��H1����Ӧ���� I3-(aq)
I3-(aq) ��H1����Ӧ���� I3-(aq) ![]() I2(aq)+I-(aq) ��H2����Ӧ�ٵĻ�ѧƽ�ⳣ��K1���¶ȵĹ�ϵ���±���
I2(aq)+I-(aq) ��H2����Ӧ�ٵĻ�ѧƽ�ⳣ��K1���¶ȵĹ�ϵ���±���
t/�� | 5 | 15 | 25 | 35 | 50 |
K1 | 1100 | 841 | 680 | 533 | 409 |
��ش�
(1)����Ӧ�ڵĻ�ѧƽ�ⳣ��ΪK2������ͬ�¶��£�K1��K2=____________��
(2)������Ӧ�ٵ���H1_______0(����>������=������<��)���������¶ȣ���I2���ܽ����ʻ�______(�����ӿ�����������������������)��
(3)���жϷ�Ӧ���Ѵﵽƽ���������_______________
A�������е�ѹǿ���ٸı� B����Һ����ɫ���ٸı�
C��I-Ũ�Ȳ��ٱ仯 D�����淴Ӧ���ʾ�Ϊ0
(4)ij�¶��£���Ӧ�ٵĻ�ѧƽ�ⳣ��Ϊ800���ڸ��¶��£���ס��ҡ������������зֱ����I2��I-�����������ʵ���ʼŨ�����£�
��ʼŨ��(mol/L) | �� | �� | �� |
c(I2) | 0.1 | 0.2 | 0.2 |
c(I-) | 0.2 | 0.1 | 0.2 |
��Ӧ����������_____________(������������������������)��ƽ��ʱI2��ת����������__________(������������������������)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1���ù�����Ʒ����һ�����ʵ���Ũ�ȵ���Һ���辭���������ܽ⡢ת����Һ�����ݵȲ���������ͼʾ��Ӧ�IJ����淶������____��
A.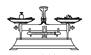 ����
����
B.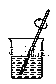 �ܽ�
�ܽ�
C.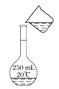 ת����Һ
ת����Һ
D.![]() ����
����
��2�����м��ֵ����Ա仯ͼ�ѷ���Ҫ���ͼ�����������Ӧ����Ŀ���������С�
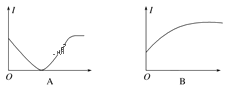
����H2SO4��Һ�м��������������ʵ���Ũ�ȵ�Ba(OH)2��Һ��____��
����AgNO3��Һͨ������HCl��____��
����ˮ��ͨ��HClֱ��������____��
����ʯ��ˮ�в���ͨ��CO2��____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
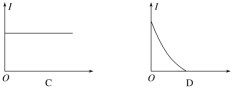
����Ŀ��һ�ֽ�CO2��H2Oת��Ϊȼ��H2��CO��CH4��װ����ͼ��ʾ(�������ҺΪϡH2SO4)�����й��ڸ�װ�õ������������
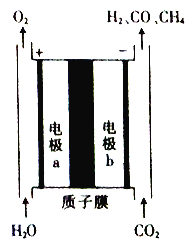
A. ��װ�ÿɽ�����ת��Ϊ��ѧ��
B. ����ʱ���缫a��Χ��Һ��pH����
C. �缫b������CH4�ĵ缫��ӦʽΪCO2+8H++8e��===CH4+2H2O
D. ���缫b��ֻ����1 mol CO����ͨ������Ĥ��H+��Ϊ2NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ������̼����ȼ�ϵ��ԭ��ʾ����ͼ�������йظõ�ص�˵����ȷ����
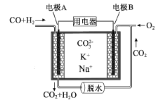
A���缫A�Ϸ������ǻ�ԭ��Ӧ
B����ع���ʱ��![]() ��缫B�ƶ�
��缫B�ƶ�
C���缫B�Ϸ����ĵ缫��ӦΪ��O2��2CO2��4e��=2![]()
D���缫A��H2����ĵ缫��ӦΪ��H2��2OH����2e��=2H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪298 Kʱ��Mg(OH)2���ܶȻ�����Ksp��5.6��10��12��ȡ������MgCl2��Һ������һ�������ռ���Һ�ﵽ�����ܽ�ƽ�⣬���pH��13��������˵������ȷ����( )
A. ������Һ�е�c(H��)��1.0��10��13mol��L��1
B. ������Һ����ˮ���������c(OH��)��1.0��10��13mol��L��1
C. ���ӵ��ռ���ҺpH��13
D. ������Һ�е�c(Mg2��)��5.6��10��10mol��L��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ����������֮����һ�����������ת���Ĺ��̡���������ɫֲ��ͨ��������õ�ͼʾ����˵������ȷ����
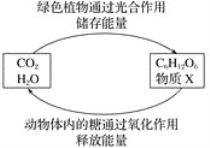
A.����X������
B.��ɫֲ��Ĺ���������ڻ�ѧ�仯
C.C6H12O6���ڷǵ����
D.C6H12O6��X��Ӧ���ɶ�����̼��ˮ�����û���Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ��298Kʱ��N2��H2��Ӧ�����������仯������ͼ��������������ȷ����
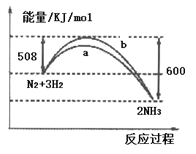
A. ���¶ȡ����һ���������£�ͨ��1mol N2��3mol H2 ��Ӧ��ų�������Ϊ92kJ
B. a�����Ǽ������ʱ�������仯����
C. ���������Ҳ�������N2��ת����
D. �÷�Ӧ���Ȼ�ѧ����ʽΪ��N2��g��+3H2��g��![]() 2NH3��g�� ��H=��92 kJ/mol
2NH3��g�� ��H=��92 kJ/mol
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com