
分析 (1)利用盖斯定律分析;
(2)电解硫酸锌溶液时,阳极上氢氧根离子放电,阴极上锌离子放电;
(3)锌、铁和电解质溶液构成的原电池中,较活泼的金属作负极,负极上失电子发生氧化反应;
解答 解:(1)①Fe2O2(s)+$\frac{1}{3}$CO(g)═$\frac{2}{3}$Fe3O4(s)+$\frac{1}{3}$CO2(g)△H=-15.73kJ.mol-1;②Fe3O4(s)+CO(g)═2FeO(s)+CO2(g)△H=+640.4kJ.mol-1
将方程式①+$\frac{2}{3}$×②得Fe2O3(s)+CO(g)=2FeO(s)+CO2(g)△H=-15.73kJ/mol+$\frac{2}{3}$(+640.4kJ/mol )=+411.20kJ/mol;
故答案为:+411.20kJ/mol;
(2)电解硫酸锌溶液时,阳极上氢氧根离子放电生成氧气,阴极上锌离子放电生成锌,电解反应方程式为:2ZnSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2Zn+O2↑+2H2SO4,
故答案为:2ZnSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2Zn+O2↑+2H2SO4;
(3)锌、铁和电解质溶液构成的原电池中,锌易失电子发生氧化反应而作负极,故答案为:氧化.
点评 本题考查盖斯定律、电解原理、原电池原理等知识点,难度不大,会判断原电池正负极、离子放电顺序,难度不大.


科目:高中化学 来源: 题型:填空题
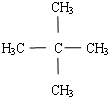 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③⑥⑦ | B. | ①②④⑦ | C. | ②③④⑥ | D. | ②③⑤⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在“镀锌铁皮厚度测量”实验中,当锌在酸中完全溶解后,产生氢气的速率会显著减慢,可借此判断镀锌铁皮中锌镀层是否完全反应 | |
| B. | 用标准NaOH溶液测定食醋总酸含量时应该使用甲基橙作为指示剂 | |
| C. | 硫酸亚铁铵晶体制备实验的最后一步是将溶液蒸发到有大量晶体析出,用余热蒸干即可得产物 | |
| D. | 将3-4个火柴头浸于水中,片刻后取少量溶液于试管中,加AgNO3溶液、稀硝酸,检验火柴头中是否含有氯元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
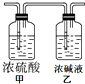 某有机物X相对氢气的密度为30,9g该有机物在空气中充分燃烧,燃烧产物依次通过右图所示的装置,实验结束后,称得甲装置增重5.4g,乙装置增重13.2g.通过计算,求
某有机物X相对氢气的密度为30,9g该有机物在空气中充分燃烧,燃烧产物依次通过右图所示的装置,实验结束后,称得甲装置增重5.4g,乙装置增重13.2g.通过计算,求查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化硼是原子晶体 | B. | 熔化时,氯化硼能导电 | ||
| C. | 氯化硼分子是一种非极性分子 | D. | 氯化硼水解得到两种弱酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
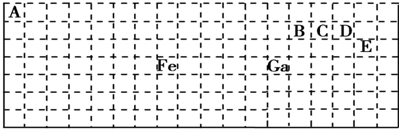
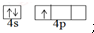 .
.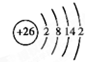
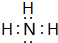 ,含有共价键化学键,E的电子表达式是
,含有共价键化学键,E的电子表达式是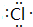 .
.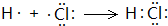 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 相关信息 | |
| X | 单质为双原子分子.若低温蒸发液态空气,因其沸点较低可先获得X的单质 |
| Y | 含Y元素的物质焰色反应为黄色 |
| Z | 同周期元素中原子半径最小 |
| R | R元素原子的最外层电子数是K层电子数的3倍 |
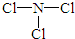 ;
;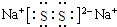 ,写出乙溶液在空气中变质过程的化学方程式4Na2S+O2+2H2O═4NaOH+2Na2S2 .
,写出乙溶液在空气中变质过程的化学方程式4Na2S+O2+2H2O═4NaOH+2Na2S2 .查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com