
| A. | 粉末中一定有Na2O、Na2O2、NaHCO3 | |
| B. | 粉末中一定不含有Na2CO3和NaCl | |
| C. | 粉末中一定含有Na2O和NaHCO3 | |
| D. | 无法肯定粉末里是否含有NaHCO3和NaCl |
分析 盐酸可以和过氧化钠反应产生氧气,和碳酸钠、碳酸氢钠反应可以释放出二氧化碳,二氧化碳可以和氢氧化钠反应,氧气不反应,碳酸氢钠受热分解会生成二氧化碳气体,氧化钠和氧气反应是固体质量增加的反应.
解答 解:向混合物中加入足量的盐酸,有气体放出,与盐酸反应产生气体的物质可能为Na2O2(生成O2)、Na2CO3或NaHCO3(生成CO2),X通过NaOH溶液后气体全部消失,说明X由CO2组成,原粉末中Na2O2一定不存在,Na2CO3和NaHCO3至少有一种一定存在.将原混合粉末加热,有气体放出,说明混合物中一定有NaHCO3,但NaHCO3受热分解会使粉末质量减小,而实际剩余固体的质量却增加了,原因只能是发生了反应:2Na2O+O2=2Na2O2; 综上分析,混合物中一定有Na2O、NaHCO3,无法确定混合物中是否有Na2CO3和NaCl.
故选C.
点评 本题考查物质的检验和鉴别,为高频考点,侧重于学生的分析能力和实验能力的考查,注意把握物质的性质以及反应现象,本题注意氧化钠和过氧化钠的性质,难度中等.


科目:高中化学 来源: 题型:解答题
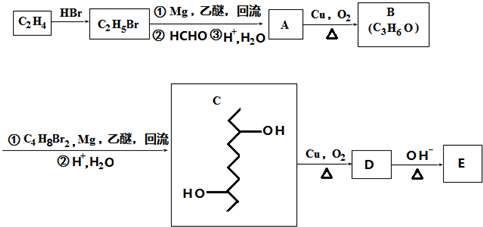
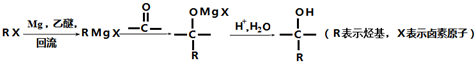

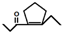 ,D在一定条件下转变为E的过程中还会生成另两种具有五元环结构的副产物,写出这两种副产物结构简式
,D在一定条件下转变为E的过程中还会生成另两种具有五元环结构的副产物,写出这两种副产物结构简式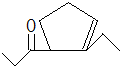 、
、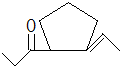 .
.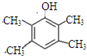 或
或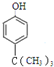
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④ | B. | ②⑤ | C. | ③⑤ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
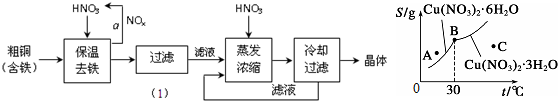
| A. | C点溶液为Cu(NO3)2的不饱和溶液 | |
| B. | 30℃时结晶可析出两种晶体 | |
| C. | 按上述流程最终得到的晶体是Cu(NO3)2•3H2O | |
| D. | 将A点溶液升温至30℃时,可以析出Cu(NO3)2•3H2O晶体. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
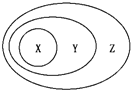
| X | Y | Z | |
| 例 | 氧化物 | 化合物 | 纯净物 |
| A | 溶液 | 分散系 | 混合物 |
| B | 铜 | 金属元素 | 元素 |
| C | 强电解质 | 电解质 | 化合物 |
| D | 置换反应 | 氧化还原反应 | 离子反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X是短周期元素中原子半径最大的 | |
| B. | X元素最高价氧化物对应的水化物,可以与其他三种元素最高价氧化物对应的水化物反应 | |
| C. | WZ4分子中每个原子最外层均达到8电子结构 | |
| D. | X元素的氧化物中只存在离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| 选项 | 实验现象 | 解释 |
| A | BaCl2溶液变浑浊 | SO2与BaCl2溶液反应产生了BaSO3沉淀 |
| B | Na2S溶液变浑浊 | SO2与Na2S溶液反应产生了S单质 |
| C | 酸性KMnO4溶液褪色 | SO2具有还原性 |
| D | 品红溶液褪色 | SO2具有漂白性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com