
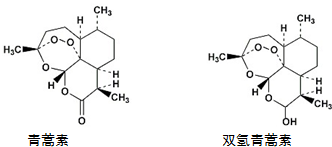
| A. | 青蒿素能发生还原反应 | |
| B. | 双氢青蒿素发生酯化反应和氧化反应 | |
| C. | 青蒿素分子中含有过氧键和酯基、醚键 | |
| D. | 双氢青蒿素分子中有2个六元环和2个七元环 |
分析 A.青蒿素中含有过氧键,具有强氧化性;
B.双氢青蒿素中含有醇羟基、醚键和过氧键,具有醇、醚和过氧化物的性质;
C.青蒿素分子中含有酯基、醚键和过氧键;
D.双氢青蒿素分子中共含有5个环,其中有3个六元环(1个六碳环、1个五碳一氧环、1个三碳三氧环)和2个七元环(1个六碳一氧环、1个五碳二氧环).
解答 解:A.青蒿素中含有过氧键,具有强氧化性,所以能发生还原反应,故A正确;
B.双氢青蒿素中含有醇羟基、醚键和过氧键,具有醇、醚和过氧化物的性质,醇羟基能发生氧化反应和酯化反应,故B正确;
C.青蒿素分子中含有酯基、醚键和过氧键,故C正确;
D.双氢青蒿素分子中共含有5个环,其中有3个六元环(1个六碳环、1个五碳一氧环、1个三碳三氧环)和2个七元环(1个六碳一氧环、1个五碳二氧环),故D错误;
故选D.
点评 本题考查有机物结构和性质,为高频考点,侧重考查学生分析判断及知识迁移能力,明确官能团及其性质关系是解本题关键,注意过氧键的性质,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:实验题
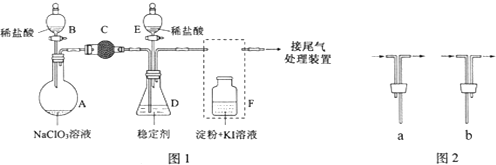
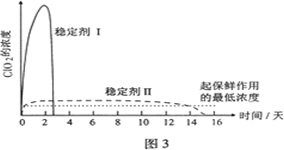
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 CH3COOCH2CH3+H2O,酯化(或取代)反应.
CH3COOCH2CH3+H2O,酯化(或取代)反应.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
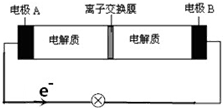 如图装置是一种可充电电池示意图,装置的离子交换膜只允许Na+通过.已知充、放电的化学方程式为2Na2S2+NaBr3$?_{充电}^{放电}$Na2S4+3NaBr,下列说法正确的是( )
如图装置是一种可充电电池示意图,装置的离子交换膜只允许Na+通过.已知充、放电的化学方程式为2Na2S2+NaBr3$?_{充电}^{放电}$Na2S4+3NaBr,下列说法正确的是( )| A. | 充电时,A极应与直流电源正极相连接 | |
| B. | 放电时,当有0.1molNa+通过离子交换膜时,B极上有0.3molNaBr产生 | |
| C. | 放电时,钠离子从左到右通过离子交换膜 | |
| D. | 放电时,负极反应式为3NaBr-2e-═NaBr3+2Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
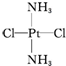 ,黄绿色固体
,黄绿色固体 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
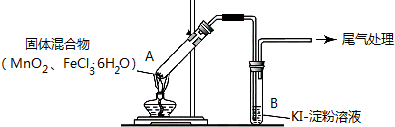
| 操作 | 现象 |
| 点燃酒精灯,加热 | i.A中部分固体溶解,上方出现白雾 ii.稍后,产生黄色气体,管壁附着黄色液滴 iii.B中溶液变蓝 |
| 方案1 | 在A、B间增加盛有某种试剂的洗气瓶C | B中溶液变为蓝色 |
| 方案2 | 将B中KI淀粉溶液替换为NaBr溶液;检验 Fe2+ | B中溶液呈浅橙红色;未检出Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,用pH计测量0.1mol•L-1FeCl3溶液的pH为a,再测量稀释10倍的0.01mol•L-1FeCl3溶液的pH为b,可判断出FeCl3水解程度与盐溶液浓度大小关系 | |
| B. | 将装有3~4mL无水乙醇的试管浸入50℃左右的热水中,将烧黑的铜丝迅速插入无水乙醇中,可观察到铜丝变红,反复数次,可闻到刺激性气味 | |
| C. | 向某溶液加浓NaOH溶液并微热,若产生的气体能使湿润的红色石蕊试纸变蓝,则说明此溶质为铵盐 | |
| D. | 酸碱中和滴定到终点读数时,发现滴定管尖嘴处悬挂一滴标准溶液,导致实验结果偏高 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com