
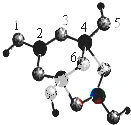
分析 由图示可以看出该结构可以表示为[H4B4O9]m-,其中B为+3价,O为-2价,H为+1价,根据化合价判断m值求解Xm-的化学式;
根据价层电子对互斥理论确定分子空间构型及中心原子杂化方式,价层电子对个数=σ键个数+孤电子对个数,σ键个数=配原子个数,孤电子对个数=$\frac{1}{2}$(a-xb),a指中心原子价电子个数,x指配原子个数,b指配原子形成稳定结构需要的电子个数,1,3,5,6代表氧原子,2,4代表B原子,2号B形成3个键,则B原子为SP2杂化,4号B形成4个键,则B原子为SP3杂化;3号氧原子形成2个单键,钠离子与Xm-形成离子键.
解答 解:观察模型,1,3,5,6代表氧原子,2,4代表B原子,可知Xm-是(H4B4O9)m-,依据化合价H为+1,B为+3,O为-2,可得m=2,则Xm-的化学式为:(H4B4O9)2-;
2号B形成3个键,价层电子对数=σ 键个数+$\frac{1}{2}$(a-xb)=3+$\frac{1}{2}$(3-3×1)=3,则B原子为SP2杂化,B一般是形成3个键,4号B形成4个键,其中1个键是配位键,配位键存在4号与5号之间,4号B形成4个键,价层电子对数=4,则B原子为SP3杂化;
3号氧原子形成2个单键,价层电子对数=σ 键个数+$\frac{1}{2}$(a-xb)=2+$\frac{1}{2}$(6-2×1)=4,所以氧原子是sp3杂化;
钠离子与Xm-形成离子键,
故答案为:(H4B4O9)2-;sp2杂化、sp3;sp3;离子键.
点评 本题考查了离子的立体构型及原子杂化方式的判断,注意杂化轨道理论的理解应用,观察模型为解答的关键,题目难度中等.


 一课一练课时达标系列答案
一课一练课时达标系列答案科目:高中化学 来源: 题型:选择题
| A. | CO2;大理石和稀硫酸,澄清石灰水 | |
| B. | Cl2;二氧化锰和浓盐酸,湿润的淀粉碘化钾试纸 | |
| C. | O2;二氧化锰和双氧水,带火星的木条 | |
| D. | NH3;氯化铵固体和氢氧化钙固体,湿润的红色石蕊试纸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 或
或 ;
; .分子式为C4H8的烃,核磁共振氢谱图中有两个吸收峰,峰面积比为3:1,请写出符合条件的所有物质的结构简式
.分子式为C4H8的烃,核磁共振氢谱图中有两个吸收峰,峰面积比为3:1,请写出符合条件的所有物质的结构简式 或
或
 ,如果要合成
,如果要合成  所用的原始原料可以是AC.
所用的原始原料可以是AC.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷与氯气混和后光照反应;乙烯使酸性高锰酸钾溶液的褪色 | |
| B. | 乙烯与溴的四氯化碳溶液反应;苯与氢气在一定条件下反应生成环己烷 | |
| C. | 在浓硫酸作用下,苯在55℃左右与浓硝酸的反应; 乙烯与水生成乙醇的反应 | |
| D. | 在苯中滴入溴水,溴水褪色; 乙烯自身生成聚乙烯的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纸的主要成分属于糖类 | |
| B. | 笔和墨的原料中都存在蛋白质 | |
| C. | 文房四宝中只有砚的成分中存在无机物 | |
| D. | 笔墨纸砚中都存在可能发生水解反应的物质类别 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com