
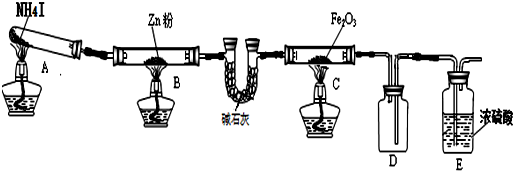
| 步骤 | 操作 | 甲组现象 | 乙组现象 |
| 1 | 取黑色粉末加入稀盐酸 | 溶解,无气泡 | 溶解,有气泡 |
| 2 | 取步骤1中溶液,滴加KSCN溶液 | 变红 | 无明显变化 |
| 3 | 向步骤2溶液中滴加新制氯水 | 红色先变深后褪去 | 先变红后也褪色 |
分析 (1)混合气体中含有碘化氢,用碱石灰可以吸收碘化氢;
(2)装置B中锌的作用是吸收碘蒸气,反应方程式:Zn+I2═ZnI2;
(3)利用黑色固体可溶于盐酸并产生气体,结合“原子守恒”判断乙组黑色粉末组成;Fe2O3被还原得到黑色固体为Fe3O4,由此可写出反应的离子方程式;
(4)氧化物样品质量为7.84克,还原成铁粉质量为5.6克,设出氧化铁和氧化亚铁的物质的量,分别根据铁的质量、总质量列式计算即可.
解答 解:(1)混合气体的碘化氢会干扰实验,则C装置中的碱石灰作用是吸收混合气体中的碘化氢,
故答案为:吸收混合气体中的HI;
(2)装置B的作用是吸收碘蒸气,锌与碘单质反应生成碘化锌,反应的化学方程式为:Zn+I2═ZnI2,
故答案为:Zn+I2═ZnI2;
(3)利用黑色固体可溶于盐酸并产生气体,结合“原子守恒”可知用酒精喷灯的乙组实验得到的固体为Fe;
根据甲组现象可知,Fe2O3与氨气在酒精灯加热的条件下,Fe2O3被还原得到黑色固体为Fe3O4,四氧化三铁与盐酸反应生成氯化铁和氯化亚铁,反应的离子方程式为:Fe3O4+8H+=2Fe3++Fe2++4H2O,
故答案为:Fe;Fe3O4+8H+=2Fe3++Fe2++4H2O;
(4)设氧化铁的物质的量为x,氧化亚铁的物质的量为y,则:160x+72y=7.84、(2x+y)×56=5.6,
联立解得:x=0.04mol、y=0.02mol,
则混合物中Fe2O3和FeO的物质的量之比为:0.04mol:0.02mol=2:1,
故答案为:2:1.
点评 本题考查性质实验方案的设计与评价,题目难度中等,注意掌握铁离子、亚铁离子的检验方法、混合物反应的计算及性质实验方案的设计与评价原则,试题综合性较强,注意正确理解、分析题中信息,试题培养了学生的分析能力及化学实验、化学计算能力.


科目:高中化学 来源: 题型:解答题
 ;
;  ;
; 
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高二上月考一化学试卷(解析版) 题型:选择题
已知:H2O(g)=H2O(l)ΔH=Q1kJ·mol-1
C2H5OH(g)=C2H5OH(l)ΔH=Q2kJ·mol-1
C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g)ΔH=Q3kJ·mol-1
若使46g酒精液体完全燃烧,最后恢复到室温,则放出的热量为
A.(Q1+Q2+Q3) kJ B.0.5(Q+Q2+Q3) kJ
C.(0.5Q1-1.5Q2+0.5Q3) kJ D.(Q2-3Q1-Q3)kJ
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 热稳定性:HCl>HF>H2O | B. | 沸点:金刚石>冰>干冰 | ||
| C. | 碱性:NaOH>Mg(OH)2>Ca(OH)2 | D. | 元素的最高正化合价:F>S>C |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com