
【题目】50mL0.5mol/L的盐酸与50mL0.55moL/L 的 NaOH 溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。
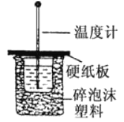
回答问题:
(1)从实验装置上看,图中尚缺少一种玻璃仪器,这种玻璃仪器的名称是_____;能否改用铁丝________ (填“能、否”),原因是____;
(2)烧杯间填满碎泡沫塑料的作用是_____;实验时氢氧化钠溶液的浓度要用 0.55 mol/L 的原因是:_____________。
(3)实验中改用 60mL0.50moL/L 盐酸跟 50mL0.55moL/L 的 NaOH 溶液进行反应,与上述实验相比,所放出的热量____ (填“偏大”“相等”或“偏小”),所求中和热_______(填“相等”或“不相等”)。
(4) 若三次平行操作测得数据中起始时盐酸与烧碱溶液平均温度相同, 而终止温度与起始温度差分别为①3.1℃②3.2℃ ③2.7℃,则最终代入计算式的温差均值为______ ℃ (保留 2 位小数)
(5)近似地认为 0.55mol/L NaOH 溶液和 0.5mol/L 盐酸密度都是1 g/cm3,中和后生成溶液的比热容 c=4.18 J/(g·℃), 则中和热ΔH=_____kJ/moL (取小数点后一位)
(6)上述实验数值结果与 57.3 kJ/mol 相比偏小,产生偏差的原因可能是(填字母)___________
a.实验装置保温、隔热效果差
b.配制 0.55 mol/L NaOH 溶液定容时俯视刻度线读数
c.分多次把 NaOH 溶液倒入盛有盐酸的小烧杯中
d.用温度计测定 NaOH 溶液起始温度后直接测定盐酸溶液的温度
e.用量筒量取盐酸溶液的体积时仰视读数
【答案】环形玻璃搅拌棒 否 与盐酸反应,并且导热使热量散失 保温、隔热,防止热量散失 使盐酸能够充分反应 偏大 相等 3.15 -52.7 a.c.d
【解析】
(1)由量热计的构造可知该装置的缺少仪器是环形玻璃搅拌棒,不能改用铁丝来搅拌,因为铁丝会和盐酸反应,并且导热使热量散失;
(2)中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎纸条的作用是保温、隔热,防止热量散失;实验时氢氧化钠溶液的浓度要用0.55 mol/L的原因是为了使盐酸能够充分反应;
(3)实验中若改用60 mL 0.50 mol/L的盐酸与50 mL 0.55 mol/L的氢氧化钠溶液进行反应,与上述实验相比,实验过程中生成H2O的物质的量增大,所放出的热量偏大;但中和热是定值,若实验操作均正确,中和热不会变化。
(4)第三次测量数据和前两次差别较大应该舍去;
(5)由(4)可知平均温度差为3.15℃,50 mL0.55 molL-1NaOH溶液与50 mL0.5 molL-1HCl溶液的质量和为m=100mL×1g/cm3=100g,c=4.18J/(g℃),代入公式Q=cm△T可得;
(6)a. 实验装置保温、隔热效果差,会造成测量结果偏小,故a可选;b. 选项量取氢氧化钠时仰视读数会使所取氢氧化钠体积增大,放出热量增多,故b不选;c. 分多次把 NaOH 溶液倒入盛有盐酸的小烧杯过程中会有热量损失,使测量结果偏小,故c可选;d. 温度计上附着的氢氧化钠和硫酸反应了,这部分热量损失了,使测量结果偏小,故d可选;e. 用量筒量取盐酸溶液的体积时仰视读数会使所取盐酸体积增大,放出热量增多,故e不选。
(1)由量热计的构造可知该装置的缺少仪器是环形玻璃搅拌棒,不能改用铁丝来搅拌,因为铁丝会和盐酸反应,并且导热使热量散失;
(2)中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎纸条的作用是保温、隔热,防止热量散失;实验时氢氧化钠溶液的浓度要用0.55 mol/L的原因是为了使盐酸能够充分反应;
(3)实验时氢氧化钠溶液的浓度要用0.55 mol/L的原因是为了确保盐酸完全被中和。实验中若改用60 mL 0.50 mol/L的盐酸与50 mL 0.55 mol/L的氢氧化钠溶液进行反应,与上述实验相比,实验过程中生成H2O的物质的量增大,所放出的热量偏大;但中和热是定值,若实验操作均正确,中和热不会变化。
(4)第三次测量数据和前两次差别较大应该舍去,前两次测量数据求平均值为![]() =3.15℃,则最终代入计算式的温差均值为3.15℃;
=3.15℃,则最终代入计算式的温差均值为3.15℃;
(5)由(4)可知平均温度差为3.4℃,50 mL0.55 molL-1NaOH溶液与50 mL0.5 molL-1HCl溶液的质量和为m=100mL×1g/cm3=100g,c=4.18J/(g℃),代入公式Q=cm△T得生成0.05mol的水放出热量Q=4.18J/(g℃)×100g×3.15℃=1316.7J=1.3167kJ,即生成0.025mol的水放出热量为:1.3167kJ,所以生成1mol的水放出热量为:1.3167 kJ×4=52.7kJ,即该实验测得的中和热△H= -52.7kJ/mol;
(6)a. 实验装置保温、隔热效果差,会造成测量结果偏小,故a可选;b. 选项量取氢氧化钠时仰视读数会使所取氢氧化钠体积增大,放出热量增多,故b不选;c. 分多次把 NaOH 溶液倒入盛有盐酸的小烧杯过程中会有热量损失,使测量结果偏小,故c可选;d. 温度计上附着的氢氧化钠和硫酸反应了,这部分热量损失了,使测量结果偏小,故d可选;e. 用量筒量取盐酸溶液的体积时仰视读数会使所取盐酸体积增大,放出热量增多,故e不选;正确答案是a.c.d。


科目:高中化学 来源: 题型:
【题目】常温下,分别将四块形状相同、质量为7g的铁块同时投入下列四种溶液中。铁块最快溶解完的是( )
A.250.0mL2mol·L-1HClB.150.0mL2mol·L-1H2SO4
C.40.0mL5mol·L-1HClD.20.0mL18.4mol·L-1H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.将pH=4的盐酸稀释后,溶液中所有离子的浓度均降低
B.0.l0mol·L-1的氨水加水稀释后,溶液中c(NH4+)、c(OH-)变大
C.常温下,向水中加入少量Na2CO3固体后,c(H+)会减小,但Kw不变
D.若![]() LpH=11的NaOH溶液与
LpH=11的NaOH溶液与![]() LpH=3的HA溶液混合后显中性,则
LpH=3的HA溶液混合后显中性,则![]() ≤
≤![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方法中可以说明2HI(g)![]() H2(g)+I2(g)已达到平衡的是:①单位时间内生成n mol H2的同时生成n mol HI;②一个H–H键断裂的同时有两个H–I键断裂;③百分组成ω(HI)=ω(I2);④反应速率υ(H2)=υ(I2)=1/2υ(HI)时;⑤ c(HI):c(H2):c(I2)=2:1:1时;⑥温度和体积一定时,容器内压强不再变化;⑦温度和体积一定时,某一生成物浓度不再变化;⑧条件一定,混合气体的平均相对分子质量不再变化;⑨温度和体积一定时,混合气体的颜色不再变化;⑩温度和压强一定时,混合气体的密度不再变化。( )
H2(g)+I2(g)已达到平衡的是:①单位时间内生成n mol H2的同时生成n mol HI;②一个H–H键断裂的同时有两个H–I键断裂;③百分组成ω(HI)=ω(I2);④反应速率υ(H2)=υ(I2)=1/2υ(HI)时;⑤ c(HI):c(H2):c(I2)=2:1:1时;⑥温度和体积一定时,容器内压强不再变化;⑦温度和体积一定时,某一生成物浓度不再变化;⑧条件一定,混合气体的平均相对分子质量不再变化;⑨温度和体积一定时,混合气体的颜色不再变化;⑩温度和压强一定时,混合气体的密度不再变化。( )
A. ②③⑤ B. ①④⑦ C. ②⑦⑨ D. ⑧⑨⑩
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1200℃时,天然气脱硫工艺中会发生下列反应
①H2S(g)+![]() O2(g)=SO2(g)+H2O(g) △H1
O2(g)=SO2(g)+H2O(g) △H1
②2H2S(g)+SO2(g)=![]() S2(g)+2H2O(g) △H2
S2(g)+2H2O(g) △H2
③H2S(g)+![]() O2(g)=S(g)+H2O(g) △H3
O2(g)=S(g)+H2O(g) △H3
④2S(g) =S2(g) △H4
则△H4的正确表达式为( )
A. △H4=2/3(△H1+△H2-3△H3)
B. △H4=2/3(3△H3-△H1-△H2)
C. △H4=3/2(△H1+△H2-3△H3)
D. △H4=3/2(△H1-△H2-3△H3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年,我国科学家研发出一种新型的锌碘单液流电池,已知M为阴离子交换膜,其原理如图所示。下列说法不正确的是
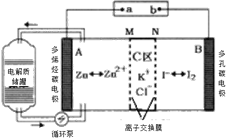
A.放电时A电极反应式为:Zn-2e﹣= Zn2+
B.充电时,B极与外接电源正极相连
C.放电时电解质储罐中离子浓度增大
D.放电时当A极减少65g时,C区Cl﹣增加2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列混合溶液中,各离子浓度的大小顺序正确的是
A. 10L0.1mol·L-1氨水与10L0.1mol·L-1盐酸混合:[Cl-]>[NH4+]>[OH-]>[H+]
B. 10mL0.1mol·L-1NH4Cl溶液与5mL0.2mol·L-1NaOH溶液混合:[Na+]=[Cl-]>[OH-]>[H+]
C. 10mL0.1mol·L-1CH3COOH溶液与5mL0.2mol·L-1NaOH溶液混合:[Na+]=[CH3COO-]>[OH-]>[H+]
D. 10mL0.5mol·L-1CH3COONa溶液与6mL1mol·L-1盐酸混合:[Cl-]>[Na+]>[OH-]>[H+]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:![]() 质子膜燃料电池工作原理如图。下列说法不正确的是
质子膜燃料电池工作原理如图。下列说法不正确的是![]()
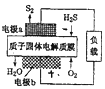
A.电池工作时,电流从电极b经过负载流向电极a
B.电极a上发生的电极反应式为![]()
C.电路中通过4mol电子时,4mol![]() 经质子膜进入正极区
经质子膜进入正极区
D.当反应生成64![]() 时,电池内部释放632kJ热量
时,电池内部释放632kJ热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L 密闭容器中充有2 mol SO2和一定量的O2,发生下列反应2SO2+O22SO3,假设反应过程中温度恒定,当反应进行到4 min时,测得SO2为0.4 mol,若反应进行到2 min时,密闭容器中SO2的物质的量为
A. 1.6 mol B. 1.2 mol C. 大于1.6 mol D. 小于1.2 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com