
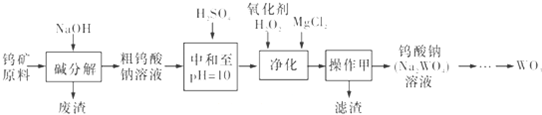
| W(CaO)/% NaOH浓度/% 浸出率/% 碱用量c/(mol.L-1) | 0.1 | 1.3 | 1.3 | 2.7 |
| 30 | 30 | 40 | 40 | |
| 1.1 | 99.1 | 90.1 | 93.3 | 83.2 |
| 1.3 | 99.4 | 92.7 | 93.0 | 82.1 |
| 1.5 | 99.5 | 93.4 | 96.5 | 83.0 |
| Ksp[Mg(OH) 2] |
| C(OH -) 2 |
| Ksp[Mg(OH) 2] |
| C(OH -) 2 |
| 5.6×10 -12 |
| (10 -4) 2 |


科目:高中化学 来源: 题型:
| A、6.02×1023就是阿伏加德罗常数 |
| B、0.012 kg 12C含有的碳原子数就是阿伏加德罗常数的值 |
| C、含有阿伏加德罗常数个粒子的物质的量是1 mol |
| D、1 mol NH3所含原子数约是2.408×1024 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
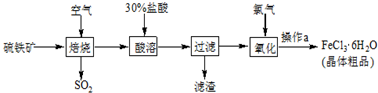
| 压强/KPa 温度/℃ | 0.1 | 0.5 | 1 | 10 |
| 400 | 99.2% | 99.6% | 99.7% | 99.9% |
| 500 | 93.5% | 96.9% | 97.8% | 99.3% |
| 600 | 73.7% | 85.8% | 89.5% | 96.4% |
查看答案和解析>>
科目:高中化学 来源: 题型:
| C |
| D |
查看答案和解析>>
科目:高中化学 来源: 题型:
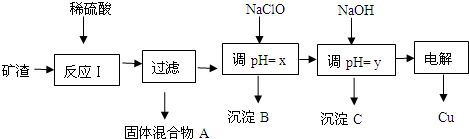
| 沉淀物 | Cu(OH)2 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀pH | 5.4 | 4.0 | 1.1 | 5.8 |
| 沉淀完全pH | 6.7 | 5.2 | 3.2 | 8.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铁跟稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ |
| B、碳酸钙跟盐酸反应:CO32-+2H+=H2O+CO2↑ |
| C、稀硫酸跟氢氧化钾溶液反应:H++OH-═H2O |
| D、氢氧化钡溶液跟稀硫酸反应:Ba2++SO42-═BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素代号 | Ⅰ1 | Ⅰ2 | Ⅰ3 | Ⅰ4 |
| R | 500 | 4600 | 6900 | 9500 |
| S | 740 | 1500 | 7700 | 10500 |
| T | 580 | 1800 | 2700 | 11600 |
| U | 420 | 3100 | 4400 | 5900 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com