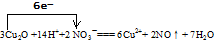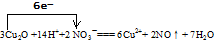将下列四种物质:NO、Cu(NO3)2、Cu2O、HNO3的化学式分别填在空白处,并组成一个配平了的化学方程式:
______+______-______+______+______H2O
(1)该反应中的还原剂是______.该反应中还原产物是______.
(2)该反应中被氧化的物质和被还原的物质物质的量之比为______
(3)写出该反应的离子方程式,并标出电子转移的方向和数目______.
解:所给的物质组合中,HNO
3中氮元素化合价位于最高价,具有氧化性,对应还原产物为NO,能将还原性的Cu
2O氧化为Cu(NO
3)
2,根据氢原子守恒,水在生成物中,故发生的反应为:3Cu
2O+14HNO
3═6Cu(NO
3)
2+2NO↑+7H
2O,
故答案为:3Cu
2O;14HNO
3;6Cu(NO
3)
2;2NO↑;7;
(1)该反应中,氧化亚铜失电子作还原剂,硝酸得电子作氧化剂,硝酸对应的产物是一氧化氮,所以NO是还原产物,故答案为:Cu
2O;NO;
(2)该反应中被氧化的物质是氧化亚铜,被还原的物质是硝酸,根据得失电子数相等知,如果有3mol氧化亚铜参加氧化还原反应,则有2mol被还原,所以被氧化和被还原的物质的物质的量之比是3:2,故答案为:3:2;
(3)该反应中氧化亚铜失电子数=3×2(2-1)=6,硝酸得电子数=2(5-2)=6,所以该离子方程式为:
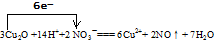
,
故答案为:
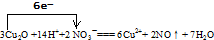
.
分析:元素处于最高价只有氧化性,元素居于低价有还原性,根据所给物质的化合价情况来分析确定反应物和生成物,氧化还原反应中,失电子化合价升高的反应物是还原剂,得电子化合价降低的反应物是氧化剂,氧化剂对应的产物是还原产物,根据方程式中化合价变化确定被氧化的物质和被还原的物质物质的量之比,并标出电子转移的方向和数目.
点评:本题考查氧化还原反应,根据元素化合价变化来分析解答即可,明确元素化合价的解本题的关键,难度不大.

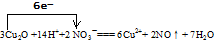 ,
,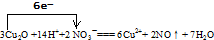 .
.

 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案