
 .
.分析 (1)Na、K均与水反应,燃烧生成的过氧化氢均与二氧化碳反应生成氧气;
(2)NaCN为离子化合物;
(3)该反应中,P元素化合价由0价变为+5价、Cl元素化合价由+5价变为-1价,得电子化合价降低的反应物是氧化剂,失电子化合价升高的反应物是还原剂,还原剂对应的产物是氧化产物;
若有1mol P4参加反应转移电子物质的量=1mol×4×(5-0);
(4)NH4NO3分解,一种可能是发生复分解反应,还有一种可能是氧化还原反应,根据氧化还原反应中有元素化合价升高就必须有元素化合价降低的原则进行书写;
(5)根据元素守恒确定X中元素,根据转移电子守恒、原子守恒确定X化学式.
解答 解:(1)Na、K均与水反应,燃烧生成的过氧化氢均与二氧化碳反应生成氧气,则钠、钾着火,可用细沙盖灭来灭火,故答案为:D;
(2)NaCN为离子化合物,电子式为Na+ ,故答案为:离子化合物;Na+
,故答案为:离子化合物;Na+ ;
;
(3)该反应中,P元素化合价由0价变为+5价、Cl元素化合价由+5价变为-1价,得电子化合价降低的反应物是氧化剂,失电子化合价升高的反应物是还原剂,还原剂对应的产物是氧化产物,所以HClO3是氧化剂、H3PO4是氧化产物;
若有1mol P4参加反应转移电子物质的量=1mol×4×(5-0)=20mol;
故答案为:HClO3; H3PO4;20;
(4)NH4NO3=NH3↑+HNO3为分解反应,但元素化合价没有发生变化,不是英汉互译反应,故答案为:NH4NO3=NH3↑+HNO3;
(5)根据元素守恒知,X中含有Na、C元素,该反应中N元素化合价由-3价转化为0价、NaCN中C元素化合价为+2价,则C元素化合价由+2价转化为+4价,转移电子数为6,根据转移电子守恒、原子守恒知X为NaHCO3,
故答案为:NaHCO3
点评 本题考查氧化还原反应的计算及含量测定等,综合性较强,注重高频考点的考查,侧重分析与计算能力的考查,注意反应中元素的化合价变化,题目难度中等.


 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案科目:高中化学 来源: 题型:选择题
| A. | 苯与浓硝酸、浓硫酸共热并保持55-60℃反应生成硝基苯 | |
| B. | 苯不能使酸性高锰酸钾褪色,说明苯环中没有碳碳双键 | |
| C. | 甲烷中混有的乙烯可以用溴的四氯化碳溶液除去 | |
| D. | 医院用75%酒精杀菌、消毒,75%是指质量分数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲苯既可使溴的四氯化碳溶液褪色,也可使酸性高锰酸钾溶液褪色 | |
| B. | 有机物  的消去(分子内脱水)产物只有2种 的消去(分子内脱水)产物只有2种 | |
| C. | 有机物A(C4H6O2)能发生加聚反应,可推知A的结构一定是CH2═CH-COOCH3 | |
| D. | 可用溴水鉴别已烯、四氯化碳和乙酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1×10-5mol/L | B. | 1×10-12mol/L | C. | 1×10-6mol/L | D. | 1×10-7mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 产品标准 | GB5461 |
| 产品等级 | 一级 |
| 配 料 | 食盐、碘酸钾、抗结剂 |
| 碘含量(以I计) | 20~50mg/kg |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
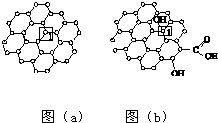 石墨烯[如图(a)所示]是一种由单层碳原子构成的平面结构新型碳材料,石墨烯中部分碳原子被氧化后,其平面结构会发生改变,转化为氧化石墨烯[如图(b)所示].
石墨烯[如图(a)所示]是一种由单层碳原子构成的平面结构新型碳材料,石墨烯中部分碳原子被氧化后,其平面结构会发生改变,转化为氧化石墨烯[如图(b)所示].查看答案和解析>>
科目:高中化学 来源: 题型:解答题
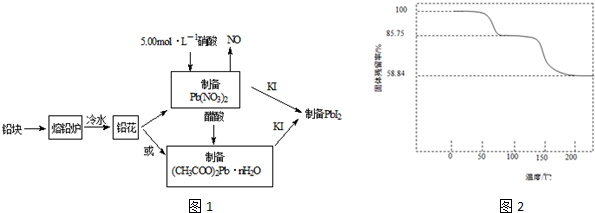
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有食品添加剂的物质均对人体健康有害 | |
| B. | 磨豆浆的大豆富含蛋白质,豆浆煮沸后蛋白质变成了氨基酸 | |
| C. | 现代海战通过喷放液体SiCl4(极易水解)和液氨可产生烟幕,其主要成分是NH4Cl | |
| D. | 明矾水解时产生具有吸附性的胶体粒子,可作漂白剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com