
磷酸燃料电池是目前较为成熟的燃料电池,其基本组成和反应原理如下。
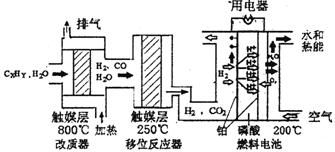
(1)在改质器中主要发生的反应为_______________________________
(2)移位反应器中CO(g)+H2O (g) 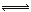 CO2 (g)+H2(g) ,在一定温度下,在1L容器中发生上述反应,各物质的物质的量浓度变化如下表:
CO2 (g)+H2(g) ,在一定温度下,在1L容器中发生上述反应,各物质的物质的量浓度变化如下表:
| t/min | COmol/L) | H2O(mol/L) | CO2(mol/L) | H2(mol/L) |
| 0 | 0.2 | 0.3 | 0 | 0 |
| 2 | n1 | n2 | n3 | 0.1 |
| 3 | n1 | n2 | n3 | 0.1 |
| 4 | 0.09 | 0.19 | 0.11 | 0.11 |
①此温度下,该反应的平衡常数为________
②反应在3~4 min之间,氢气的物质的量增多的原因可能是 (填代号)
A.充入水蒸汽 B.升高温度 C.使用催化剂 D.充入氢气
(3)磷酸燃料电池负极排出的气体主要是___ __,
该电池正极的电极反应为_ _ __。
(4)磷酸燃料电池的电极上镀了铂粉,这样做的目的,除了起到更好的导电作用外,还具备的作用是 。
(5)总体看来,整个体系中能量来自与CxHy与空气的反应,假设CxHy为辛烷,且
已知辛烷的燃烧热为5 518 kJ·mol-1,请写出辛烷燃烧热的热化学方程式 。
【知识点】燃料电池原理 化学平衡的移动 热化学方程式 F1 F3 G2
【答案解析】(1)CxHy+XH2O  XCO+(X+Y/2)H2
XCO+(X+Y/2)H2
(2)① 0.5② B
(3) CO2 O2 +4H++4e--=2H2O
(4) 增大电极单位面积吸附H2、O2分子数,加快反应速率
(5) C8H18(l)+ O2(g)===8CO2(g)+9H2O(l);ΔH=-5 518 kJ·mol-1
O2(g)===8CO2(g)+9H2O(l);ΔH=-5 518 kJ·mol-1
解析:(1)改质器中进入的物质是烃和水,反应温度是800℃,出来的气体是水、氢气和一氧化碳,所以发生的化学反应:CxHy+XH2O  XCO+(X+Y/2)H2(2)①根据氢气浓度增加了0.1mol/L, n1、n2、n3分别为0.1mol/L、0.2mol/L、0.1mol/L,k=
XCO+(X+Y/2)H2(2)①根据氢气浓度增加了0.1mol/L, n1、n2、n3分别为0.1mol/L、0.2mol/L、0.1mol/L,k=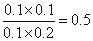 ;② 反应物的浓度都减小了0.1mol/L,生成物的浓度都增大了0.1mol/L,排除ADC,选B;(3)燃料电池中,负极上燃料失去电子发生氧化反应,二氧化碳是废气,所以排出的气体是二氧化碳,正极上氧化剂得电子和氢离子反应生成水,电极反应式为O2+4H++4e-=2H2O(4)磷酸燃料电池的电极上镀了铂粉,这样做的目的,除了起到更好的导电作用外,还具备的作用是增大电极单位面积吸附H2、O2分子数,加快反应速率,(5)根据燃烧热的定义及热化学方程式的要求得: C8H18(l)+
;② 反应物的浓度都减小了0.1mol/L,生成物的浓度都增大了0.1mol/L,排除ADC,选B;(3)燃料电池中,负极上燃料失去电子发生氧化反应,二氧化碳是废气,所以排出的气体是二氧化碳,正极上氧化剂得电子和氢离子反应生成水,电极反应式为O2+4H++4e-=2H2O(4)磷酸燃料电池的电极上镀了铂粉,这样做的目的,除了起到更好的导电作用外,还具备的作用是增大电极单位面积吸附H2、O2分子数,加快反应速率,(5)根据燃烧热的定义及热化学方程式的要求得: C8H18(l)+ O2(g)===8CO2(g)+9H2O(l);ΔH=-5 518 kJ·mol-1注意辛烷为液态,放热反应的ΔH为负。
O2(g)===8CO2(g)+9H2O(l);ΔH=-5 518 kJ·mol-1注意辛烷为液态,放热反应的ΔH为负。
【思路点拨】本题考查了燃料电池的基本原理,难度不大,注意电极反应式的书写要结合电解质溶液的酸碱性,电解质溶液的酸碱性不同,电极反应式可能不同。注意辛烷为液态,放热反应的ΔH为负。


科目:高中化学 来源: 题型:
下列表示对应化学反应的离子方程式正确的是
A. NaHSO4 溶液与Ba(OH)2溶液反应至中性:
2H++SO42-+Ba2++2OH-=BaSO4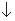 +2H2O
+2H2O
B. 向FeCl2溶液中通入氯气:Fe2++ Cl2= Fe3++2Cl-
C. 向Ca(ClO)2溶液中通入过量的SO2:ClO-+ SO2+ H2O= HClO+ HSO3-
D. FeSO4酸性溶液中加H2O2: 2Fe2++ H2O2= 2Fe3++2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
1体积某烃的蒸气完全燃烧生成的CO2比水蒸气少1体积(在同温同压下测定),0.1 mol该烃完全燃烧的产物全部被碱石灰吸收,碱石灰增重 51.4 g。试解答:
(1)求该烃的分子式________________________________________________________;
(2)若该烃的一氯代物只有一种,试写出该烃的结构简式并用系统命名法命名
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
将有机物完全燃烧,生成CO2和H2O。将12 g该有机物完全燃烧后的产物通过浓H2SO4,浓H2SO4增重14.4 g,再通过碱石灰,碱石灰增重26.4 g。该有机物分子式为( )
A.C4H10 B.C2H6O
C.C3H8O D.C2H4O2
查看答案和解析>>
科目:高中化学 来源: 题型:
某有机物3.24 g装入元素分析装置,通入足量的氧气使之完全燃烧,将生成的气体依次通过无水CaCl2(A)管和碱石灰(B)管,测得A管增重2.16 g,B管增重9.24 g,已知该有机物的相对分子质量小于200。求该有机物的最简式和化学式。
查看答案和解析>>
科目:高中化学 来源: 题型:
如图是锌、铜和稀硫酸形成的原电池,下列叙述不合理的是
A.溶液中H+向Zn电极移动
B.外电路中电流方向为:Cu→Zn
C.负极上的电极反应:Zn-2e-===Zn2+
D.有1 mol电子流过导线,则Cu电极上产生的H2为11.2 L(标准状况)
查看答案和解析>>
科目:高中化学 来源: 题型:
2010年4月中旬全球核安全峰会在华盛顿举行,发展核电、制裁核武器发展是会议主题,各式各样电池的发展是化学对人类的一项重大贡献,下列有关电池的叙述正确的是
A.手机上用的锂离子电池属于一次电池
B.锌锰干电池中,锌电极是负极
C.氢氧燃料电池工作时氢气在负极被还原
D.太阳能电池的主要材料为二氧化硅
查看答案和解析>>
科目:高中化学 来源: 题型:
已知A为淡黄色固体,T、R为两种常见的用途很广的金属单质,D是具有磁性的黑色晶体, C是无色无味的气体,H是白色沉淀,且在潮湿空气中迅速变为灰绿色,最终变为红褐色固体。
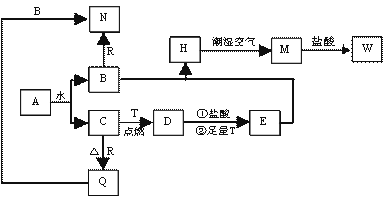
(1)写出下列物质的化学式:
A: D: R: 。
(2)按要求写下列反应方程式:
H在潮湿空气中变成M的过程中的化学方程式: ;
向N中通足量CO2时反应的离子方程式: ;
D与盐酸反应的离子方程式: 。
(3)简述检验气体C的方法: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关金属的说法中,正确的是
①纯铁不容易生锈 ②钠着火用水扑灭 ③KSCN溶液可以检验Fe3+
④缺钙会引起骨质疏松,缺铁会引起贫血 ⑤青铜、不锈钢、硬铝都是合金
A.①③④ B.②③④⑤ C.①③④⑤ D.①②⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com