
 氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点.
氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点.分析 (1)利用盖斯定律①×2-②得:CH4(g)+2H2O(g)═CO2(g)+4H2(g)解答,从待求反应出发分析反应物、生成物在所给反应中的位置,通过相互加减可得;
(2)2H2S(g)?2H2(g)+S2(g)△H=+169.8kJ•mol-1,
①依据化学平衡移动原理可知压强增大平衡向气体体积减小的方向进行;
②图分析可知升温H2S的转化率增大,说明升温平衡正向进行,平衡常数增大;
③结合化学平衡三行计算列式计算平衡物质的物质的量,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数;
④如果想进一步提高H2S的转化率,除改变温度、压强外,可以减少生成物浓度促进平衡正向进行,提高硫化氢的转化率;
(3)甲烷-空气碱性(KOH为电解质)燃料电池是甲烷失电子在碱溶液中发生氧化反应生成碳酸盐,单位质量的输出电能叫能量密度,能量密度之比等于单位质量的可燃物转移电子数之比计算.
解答 解:(1)①CH4(g)+H2O(g)═CO(g)+3H2(g)△H=206.2kmol-1
②CH4(g)+CO2(g)═2CO(g)+2H2(g)△H=247.4kJmol-1
据盖斯定律,①×2-②得:CH4(g)+2H2O(g)═CO2(g)+4H2(g)△H=165.0kmol-1,
故答案为:CH4(g)+2H2O(g)═CO2(g)+4H2(g)△H=+165.0kJ•mol-1;
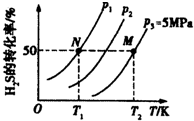
(2)①2H2S(g)?2H2(g)+S2(g)△H=+169.8kJ•mol-1,反应是气体体积增大的反应,温度不变,压强增大平衡逆向进行,H2S的转化率减小,则压强关系为:P1<P2<P3,
故答案为:P1<P2<P3,该可逆反应的正反应是气体分子数增大的反应,相同温度下,增大压强平衡逆向进行,H2S的转化率减小;
②反应是吸热反应,平衡移动原理可知,升温平衡正向进行,图分析可知升温H2S的转化率增大,说明升温平衡正向进行,平衡常数增大,K(T1)<K(T2),
故答案为:<,该可逆反应的正反应是吸热反应,升高温度,平衡常数增大;
③M点的H2S转化率为50%,总压为5MPa,设H2S起始量为2mol,
2H2S(g)?2H2(g)+S2(g)
起始量(mol) 2 0 0
变化量(mol) 1 1 0.5
平衡量(mol) 1 1 0.5
Kp=$\frac{(5×\frac{1}{2.5})^{2}×5×\frac{0.5}{2.5}}{(5×\frac{1}{2.5})^{2}}$=1,故答案为:1;
④如果想进一步提高H2S的转化率,除改变温度、压强外,可以减少生成物浓度促进平衡正向进行,提高硫化氢的转化率,采取的措施有及时分离出产物,
故答案为:及时分离出产物;
(3)甲烷-空气碱性(KOH为电解质)燃料电池的负极反应式为CH4-8e一+10OH-=CO32-+7H20,设甲烷和氢气质量为16g,则预计电极反应计算电子转移总数计算得到能量密度之比,CH4-8e一+10OH-=CO32-+7H20,16g甲烷燃烧电子转移8mol,16g氢气物质的量8mol,电子转移16mol,H2-2e-=2H+,所以相同条件下,甲烷燃料电池与氢气燃料电池的能量密度之比为8:16=1:2,
故答案为:CH4-8e-+10OH-=CO32-+7H2O;1:2.
点评 本题考查热化学方程式书写、化学平衡图象、影响化学平衡的因素、化学平衡常数、原电池原理和电极书写等,难度中等,注意利用“定一议二”原则分析和电子转移总数计算.


科目:高中化学 来源: 题型:选择题
| A. | “春蚕到死丝方尽、蜡炬成灰泪始干”中的“丝”的主要成分是纤维素,属于天然高分子化合物 | |
| B. | “千锤万凿出深山,烈火焚烧若等闲”的过程中不但有物理变化,也有化学变化 | |
| C. | 日常生活中常用汽油去除衣物上的油污,用热的纯碱溶液洗涤炊具上的油污,两者的原理完全相同 | |
| D. | “84”消毒液的有效成分为NaClO,“洁厕灵”的有效成分为HCl,若将两者混合使用,其杀菌效果和去除厕所污渍的效果都将加强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
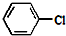 +2NaOH$\stackrel{加热加压}{→}$
+2NaOH$\stackrel{加热加压}{→}$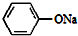 +NaCl+H2O
+NaCl+H2O
 .
. 、
、 ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
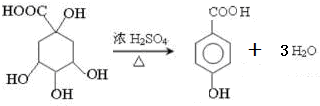
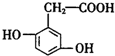 ,则下列说法错误的是( )
,则下列说法错误的是( )| A. | 1mol尿黑酸与足量的浓溴水反应,最多消耗3mol Br2 | |
| B. | 1mol尿黑酸最多能与4mol H2反应 | |
| C. | 尿黑酸分子中在同一平面上的碳原子至少有7个 | |
| D. | 尿黑酸可与碳酸氢钠溶液反应放出CO2,生成2.24LCO2(标况下)需要尿黑酸16.8g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
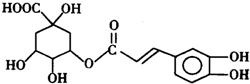 .
.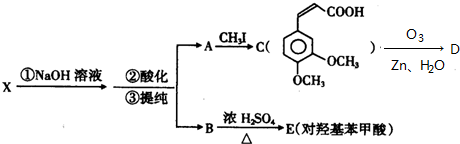
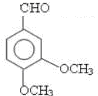 ;
; ;
;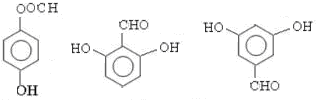 任意一种;(任写一种)
任意一种;(任写一种)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学式 | 电离常数 |
| CH3COOH | Ka=1.76×10-5 |
| H2SO3 | ${K_{a_1}}$=1.54×10-2 |
| ${K_{a_2}}$=1.02×10-7 | |
| HF | Ka=6.03×10-4 |
| A. | 1mol•L-1NaHA溶液中一定存在:c(Na+)=c(H2A)+c(HA-)+c(A2-) | |
| B. | 向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | |
| C. | pH均等于3的醋酸与盐酸溶液等体积混合后,溶液的pH变大 | |
| D. | 已知某温度下常见弱酸的电离平衡常数如表:相同物质的量浓度的CH3COONa、NaF、Na2SO3、NaHSO3水溶液,溶液中离子总数由小到大排列的顺序是Na2SO3<CH3COONa<NaF<NaHSO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙二醇和丙三醇互为同系物 | |
| B. | 不同元素的原子构成的分子只含极性共价键 | |
| C. | ${\;}_{92}^{235}$U和${\;}_{92}^{238}$U是中子数不同质子数相同的同种核素 | |
| D. | 短周期第ⅣA与ⅦA族元素的原子间构成的分子,均满足原子最外层8电子结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
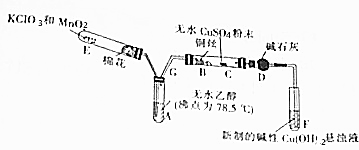
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
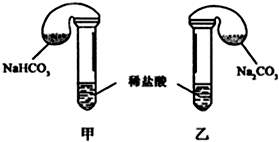
| 试剂用量 | 实验现象 (气球体积变化) | 分析原因 | |
| 第 ① 组 | 42g NaHCO3 53g Na2CO3 300mL4mol/L盐酸 | 甲中气球与乙中 气球的体积相等 | 甲、乙盐酸均过量 n(NaHCO3)=n (Na2CO3) V甲(CO2)=V乙(CO2) |
| 第 ② 组 | 42g NaHCO3 53g Na2CO3 300mL3mol/L盐酸 | 甲中气球体积大于乙中气球的体积(填“大于”或“小于” 或“等于”) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com