
| A. | MgO和Al2O3均只能与酸反应,不能与碱反应 | |
| B. | Na和Fe在一定条件下与水反应都生成H2和对应的碱 | |
| C. | Mg和Al都可以用电解法冶炼得到 | |
| D. | Na2O和Na2O2与CO2反应产物相同 |
分析 A.Al2O3能与强碱溶液反应;
B.Fe与水蒸气反应生成四氧化三铁;
C.Mg、Al属于活泼金属要用电解法冶炼;
D.Na2O与CO2反应生成碳酸钠,Na2O2与CO2反应生成碳酸钠和氧气.
解答 解:A.Al2O3属于两性氧化物能与强碱溶液反应生成盐和水,MgO属于碱性氧化物与碱不反应,故A错误;
B.Fe与水蒸气反应生成四氧化三铁,不生成碱,Mg与热水反应生成氢氧化镁,故B错误;
C.Mg、Al属于活泼金属要用电解法冶炼,分别电解熔融的氯化镁和氧化铝,故C正确;
D.Na2O与CO2反应生成碳酸钠,Na2O2与CO2反应生成碳酸钠和氧气,所以Na2O和Na2O2与CO2反应产物不完全相同,故D错误.
故选C.
点评 本题考查较为综合,涉及金属的性质以及应用,为高频考点,侧重于基础知识的综合理解和运用的考查,难度不大,注意相关基础知识的积累.


科目:高中化学 来源: 题型:选择题
| A. | Cl-的结构示意图: | |
| B. | 乙酸的结构示意图:C2H4O2 | |
| C. | 硫酸的电离方程式:H2SO4═H2++SO42- | |
| D. | 氯化钠的电子式: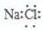 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO2 | B. | NO | C. | N2 O | D. | N2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
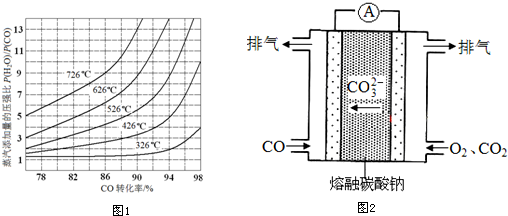
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合c(Na+)+c(H+)=c(OH-)+c( HC2O4-) | |
| B. | Na2S溶液:c(Na+)>c(HS-)>c(OH-)>c(H2S) | |
| C. | NaHSO4溶液:c(H+)=c(SO42-)十c(OH-) | |
| D. | pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中c(Cl-)>c(H+)>c(NH4+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
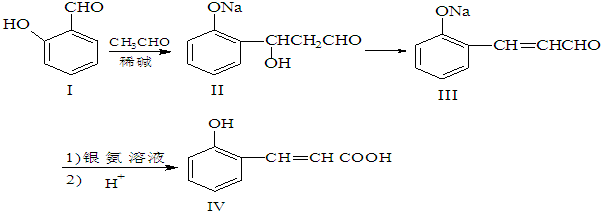
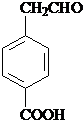
 ;
; 、
、
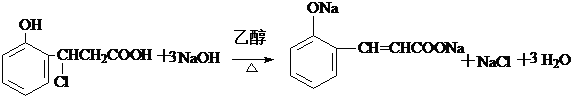 或
或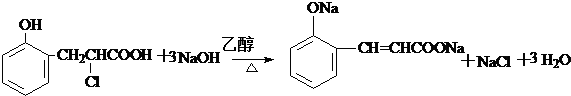 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
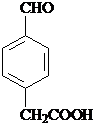
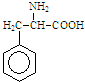 某有机物结构简式如图.一定条件下,该物质与甘氨酸(NH2-CH2-COOH)混合发生反应生成的链状二肽有( )
某有机物结构简式如图.一定条件下,该物质与甘氨酸(NH2-CH2-COOH)混合发生反应生成的链状二肽有( )| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
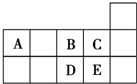
| A. | D在过量的B中燃烧的主要产物为DB3 | |
| B. | C的氢化物的水溶液酸性比E的强 | |
| C. | A与B形成的阴离子可能有AB32-、A2B42- | |
| D. | 原子半径:A>B>C |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度,KW增大,pH不变 | |
| B. | 向水中加入氨水,平衡向逆反应方向移动,c(OH-)降低 | |
| C. | 向水中加入少量硫酸氢钠固体,平衡向逆反应方向移动,c(H+)增大,KW不变 | |
| D. | 向水中加入少量固体CH3COONa,平衡向逆反应方向移动,c(H+)降低 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com