
分析 (1)在电解池中,如果阳极是活泼电极,则电极本身发生失电子的氧化反应,阴极上是阳离子发生得电子的还原反应,据此书写电极反应;
(2)Cr2O72-具有强氧化性,可以将亚铁离子氧化为铁离子,自身被还原为2Cr3+,据此书写方程式;
(3)根据溶度积常数以及水的离子积常数来进行计算.
解答 解:(1)用Fe为电极进行电解,阳极是活泼电极,则电极本身发生失电子的氧化反应,即Fe-2e-═Fe2+,阴极上是阳离子发生得电子的还原反应,即2H++2e-═H2↑,
故答案为:2H++2e-═H2↑;
(2)Cr2O72-具有强氧化性,可以将亚铁离子氧化为铁离子,自身被还原为2Cr3+,反应的实质是:6Fe2++Cr2O72-+14H+═6Fe3++2Cr3++7H2O,
故答案为:6Fe2++Cr2O72-+14H+═6Fe3++2Cr3++7H2O;
(3)当c(Cr3+)=10-5mol/L时,溶液的c(OH-)=$\root{3}{\frac{1{0}^{-32}}{1{0}^{-5}}}$=10-9 mol/L,
c(H+)═$\frac{1{0}^{-14}}{1{0}^{-9}}$=10-5mol/L,pH=5,
即要使c(Cr3+)降至10-5mol/L,溶液的pH应调至5,
故答案为:5.
点评 本题考查了电解原理、难溶物溶度积的计算、题目难度中等,涉及的知识点较多,注意掌握电解原理、难溶物溶度积的概念及计算方法,试题培养了学生的分析、理解能力及化学计算能力.


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:多选题
| A. | 至少存在4种离子 | |
| B. | Cl-一定存在,且c(Cl )≥0.4 mol/L | |
| C. | SO42-、NH4+,一定存在,Cl-可能不存在 | |
| D. | CO32-、Al3+一定不存在,K+可能存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅酸钠属于盐,不属于碱,所以硅酸钠可以保存在磨口玻璃塞试剂瓶中 | |
| B. | 反应①Na2SiO3+H2O+CO2═Na2CO3+H2SiO3↓,反应②Na2CO3+SiO2$\frac{\underline{\;高温\;}}{\;}$NaSiO3+CO2↑,两反应是相互矛盾的,不可能都发生 | |
| C. | 普通玻璃、石英玻璃、水泥等均属于硅酸盐材料 | |
| D. | 祖母绿的主要成分为Be3Al2Si6O18,用氧化物形式表示为3BeO•Al2O3•6SiO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 图中的每一方格表示相关的一种反应物或生成物.其中B是一种单质,其余物质也都是有B元素的化合物.C是一种钠盐,E是C的对应的酸,B的结构类似金刚石,D为B的氧化物(其他不含B元素的反应产物以及各步反应添加的必要试剂和反应条件已被略去),请填写空白:
图中的每一方格表示相关的一种反应物或生成物.其中B是一种单质,其余物质也都是有B元素的化合物.C是一种钠盐,E是C的对应的酸,B的结构类似金刚石,D为B的氧化物(其他不含B元素的反应产物以及各步反应添加的必要试剂和反应条件已被略去),请填写空白:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
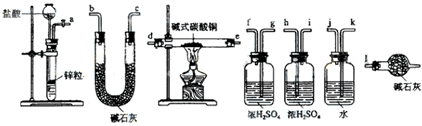
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 依据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图所示:
依据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图所示:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com