
已知在25℃时,几种物质的0.1mol/L溶液的电离度如下表:

将足量的锌粒分别放入等体积pH=1的 ①![]() 溶液 ②盐酸 ③醋酸溶液④
溶液 ②盐酸 ③醋酸溶液④![]() 溶液中,放出H2的量关系正确的是
溶液中,放出H2的量关系正确的是
[ ]

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| 弱酸 | CH3COOH | H2SO3 | HCN |
| 物质的量浓度mol/L | 0.01 | 0.01 | 0.01 |
| pH | 3.4 | 2.3 | 5.6 |

 HSO3-+OH-
HSO3-+OH- HSO3-+OH-
HSO3-+OH-| c(H+) |
| c(CH3COOH) |
 H+(aq)+CN-(aq)△H=+43.5kJ?mol-1
H+(aq)+CN-(aq)△H=+43.5kJ?mol-1 HCN(aq)+OH-(aq)的△H=
HCN(aq)+OH-(aq)的△H=查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料.已知在101kPa时,32.0gN2H4在氧气中完全燃烧生成氮气,放出热量624kJ(25℃时),N2H4完全燃烧反应的热化学方程式是
(1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料.已知在101kPa时,32.0gN2H4在氧气中完全燃烧生成氮气,放出热量624kJ(25℃时),N2H4完全燃烧反应的热化学方程式是
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、三种物质在常温下溶解度最小的是AgI | B、饱和AgCl溶液中,c(Ag+)≈1.34×10-5mol/L | C、将氯化银置于饱和KI溶液中,固体慢慢会由白色转化为黄色 | D、将浓度均为1×10-6mol/L的AgNO3溶液、KBr溶液等体积混合会生成沉淀 |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年安徽省高三年级第一次联考理综化学试卷(解析版) 题型:填空题
工业上以黄铜矿(主要成分是CuFeS2,杂质不溶于水和酸)为原料,制备蓝色晶体G,其化学式为[Cu(NH3)4]SO4·H2O,涉及流程如下:
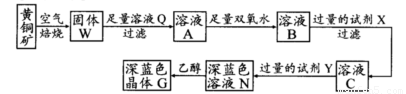
已知25℃时,几种金属氢氧化物的溶度积常数和完全沉淀的pH范围如下表:
|
|
Fe(OH)2 |
Cu(OH)2 |
Fe(OH)3 |
|
Ksp |
8.0×10-16 |
2.2×10-22 |
4.0×10-38 |
|
完全沉淀pH |
≥9.6 |
≥6.4 |
≥3.2 |
(1)加快黄铜矿焙烧速率,可采用的措施有 (写两种):
(2)加入双氧水可能发生反应的离子方程式为 ;
试剂X的化学式为 。
(3)常温下,0.1 mol/L试剂Y的pH=11,则该温度下,试剂Y的电离常数为 ;
用pH试纸测该溶液pH值的方法是
(4)已知Cu(OH)2+4NH3·H2O [Cu(NH3)4]2++2OH-+4H2O,写出该反应的平衡常数表达式:
。
[Cu(NH3)4]2++2OH-+4H2O,写出该反应的平衡常数表达式:
。
(5)在溶液N中加入乙醇的目的是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com