
分析 B与浓硫酸混合加热,控制温度可以得到一种能使溴的四氯化碳溶液褪色,并可作果实催熟剂的无色气体C,则C是CH2=CH2、B为CH3CH2OH,A为酯,根据A分子式知,组成A的羧酸是HCOOH,所以A为HCOOCH2CH3;B在一定温度和催化剂存在的条件下,能被空气氧化为D,D与新制的Cu(OH)2悬浊液加热煮沸,有红色沉淀和E生成,则D是CH3CHO、E为CH3COOH,据此分析解答.
解答 解:B与浓硫酸混合加热,控制温度可以得到一种能使溴的四氯化碳溶液褪色,并可作果实催熟剂的无色气体C,则C是CH2=CH2、B为CH3CH2OH,A为酯,根据A分子式知,组成A的羧酸是HCOOH,所以A为HCOOCH2CH3;B在一定温度和催化剂存在的条件下,能被空气氧化为D,D与新制的Cu(OH)2悬浊液加热煮沸,有红色沉淀和E生成,则D是CH3CHO、E为CH3COOH,
(1)A是甲酸乙酯、B是乙醇,甲酸乙酯碱性条件下水解生成乙醇和甲酸盐,反应方程式为HCOOCH2CH3+NaOH$\stackrel{△}{→}$HCOONa+CH3CH2OH,该反应的反应类型是取代反应或水解反应,
故答案为:HCOOCH2CH3+NaOH$\stackrel{△}{→}$HCOONa+CH3CH2OH、取代反应或水解反应;
(2)B是乙醇、C是乙烯,乙醇发生消去反应生成乙烯,反应方程式为CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O,反应类型是消去反应,
故答案为:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O、消去反应;
(3)B是乙醇、D是乙醛,乙醇发生催化氧化反应生成乙醛,反应方程式为2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O,反应类型是氧化反应,
故答案为:2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O、氧化反应;
(4)D是乙醛、E是乙酸,乙醛发生氧化反应生成乙酸,反应方程式为CH3CHO+2Cu(OH)2$\stackrel{△}{→}$CH3COOH+Cu2O↓+2H2O,反应类型是氧化反应,故答案为:CH3CHO+2Cu(OH)2$\stackrel{△}{→}$CH3COOH+Cu2O↓+2H2O、氧化反应.
点评 本题考查有机物推断,为高频考点,涉及酯、醇、醛、羧酸、烯烃之间的转化,以乙烯为突破口采用正逆结合的方法进行推断,注意结合反应条件分析,题目难度不大.


 黄冈创优卷系列答案
黄冈创优卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 己烷(己烯):加入溴水,分液 | B. | 硝酸钾(氯化钠):浓溶液降温结晶 | ||
| C. | Fe3+(Al3+)):过量的氨水,过滤 | D. | CO2(CO):点燃 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用惰性电极电解饱和食盐水时,阳极的电极反应式为:2H+-2e-═H2↑ | |
| B. | 氢氧燃料电池的负极反应式:O2+2H2O+4e-═4OH- | |
| C. | 钢铁发生电化学腐蚀的负极反应式:Fe-2e-═Fe2+ | |
| D. | 粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu-2e-═Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X有多种气态氢化物 | B. | 原子半径:R>W | ||
| C. | 气态氢化物的热稳定性:R>Y | D. | 最高价氧化物的水化物的酸性:X>R |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C3H8,C4H6 | B. | C3H6,C3H8O | C. | C2H6,C4H6O2 | D. | CH4O,C3H4O5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
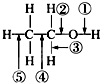 乙醇分子中的各种化学键如图所示,下列关于乙醇在各种反应中断裂键的说明不正确的是( )
乙醇分子中的各种化学键如图所示,下列关于乙醇在各种反应中断裂键的说明不正确的是( )| A. | 和金属钠反应时①键断裂 | |
| B. | 和乙酸发生酯化反应时②键断裂 | |
| C. | 在铜催化及加热条件下与O2反应时断裂①键和⑤键 | |
| D. | 在空气中完全燃烧时断裂①②③④⑤键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通过足量的NaOH溶液 | B. | 通过足量的溴水 | ||
| C. | 在Ni催化、加热条件下通入H2 | D. | 通过足量的酸性KMnO4溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com