
| A. | 铝的表面容易形成致密的氧化膜,抗腐蚀性能好 | |
| B. | 常温下不与碱反应 | |
| C. | 铝元素在地壳中的含量高,储量丰富 | |
| D. | 工业上可以用电解法冶炼铝 |
分析 A.金属铝易被氧气氧化形成致密的氧化铝保护膜;
B.金属铝化学性质活泼,可以和酸反应,可以与强碱反应;
C.根据Al元素在地壳中的含量来分析;
D.工业上用电解熔融的氧化铝冶炼铝.
解答 解:A.金属铝易被氧气氧化形成致密的氧化膜氧化铝,抗腐蚀性能好,故A正确;
B.金属铝化学性质活泼,常温下可以和酸反应,能与氢氧化钠等强碱反应,故B错误;
C.Al元素在地壳中是含量最多的金属元素,含量高,储量丰富,故C正确;
D.工业上用电解熔融的氧化铝冶炼铝,故D正确;
故选B.
点评 本题考查物质的性质,为高频考点,把握物质的性质及发生的反应、性质与用途等为解答的关键,侧重分析与应用能力的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 在化学反应过程中,发生物质变化的同时不一定发生能量变化 | |
| B. | 在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,则表示氢气燃烧热的热化学方程式为:2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ/mol | |
| C. | 温度、浓度的改变一定会引起反应速率的改变,所以化学平衡一定会移动 | |
| D. | 酸与碱恰好完全反应生成正盐,其中c(H+)=c(OH-)=10-6 mol/L的溶液一定呈中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 向100mL 3mol/L的NaOH溶液中缓慢通入一定量的CO2,充分反应,测得最后溶液的PH>7.
向100mL 3mol/L的NaOH溶液中缓慢通入一定量的CO2,充分反应,测得最后溶液的PH>7.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ,B
,B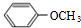 ,C
,C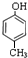 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
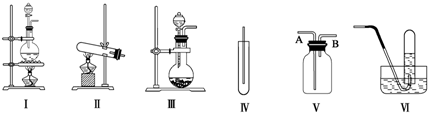
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用铜为电极电解饱和食盐水:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH- | |
| B. | 浓硝酸溶液中加入过量铁粉并加热:Fe+3NO3-+6H+$\frac{\underline{\;\;△\;\;}}{\;}$Fe3++3NO2↑+3H2O | |
| C. | 0.01mol/LNH4Al(SO4)2溶液与0.02mol/LBa(OH)2溶液等体积混合:NH4++Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+Al(OH)3↓+NH3•H2O | |
| D. | 向小苏打溶液中加少量Ba(OH)2溶液:HCO3-+Ba2++OH-═BaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
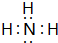 .实验室制取该种物质的化学方程式为Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$ 2NH3↑+CaCl2+2H2O.
.实验室制取该种物质的化学方程式为Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$ 2NH3↑+CaCl2+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeO42- 只做氧化剂 | |
| B. | O2是还原产物 | |
| C. | □处对应的物质是H2O | |
| D. | 若10 mol H+参加反应,转移的电子的物质的量是10 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤②④ | B. | ②④③①⑤ | C. | ③①②⑤④ | D. | ②④①③⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com