
对于反应2SO2+O2 2SO3,下列判断正确的是(双选)( )
2SO3,下列判断正确的是(双选)( )
A.2体积SO2和足量O2反应,必定生成2体积SO3
B.其他条件不变,增大压强,平衡必定向右移动
C.平衡时,SO2消耗速率必定等于O2生成速率的2倍
D.平衡时,SO2浓度必定等于O2浓度的2倍
科目:高中化学 来源: 题型:
下列离子方程式正确的是( )。
A.铁粉加入三氯化铁溶液中 Fe +Fe3+ = 2Fe2+
B.Cl2与水的反应Cl2 + H2O === 2H+ + Cl -+ ClO-↑
C.铜片插入硝酸银溶液中Cu + Ag+ === Cu2+ + Ag
D.大理石溶于醋酸的反应CaCO3 + 2CH3COOH === Ca2+ + 2CH3COO- +CO2↑+ H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
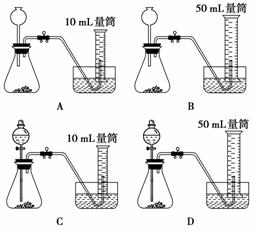
比较MnO2和CuO对H2O2分解反应的催化能力大小的实验中若催化剂的质量均控制在0.1 g,6%的H2O2溶液均取5 mL,可选择的实验装置是( )
查看答案和解析>>
科目:高中化学 来源: 题型:
从植物花中提取一种有机物,可用简化式HIn表示,在水溶液中因存在下列电离平衡:HIn(溶液红色)  H+(溶液)+In-(溶液黄色),故可用作酸碱指示剂。在该水溶液中加入下列物质,能使该指示剂显黄色的是( )
H+(溶液)+In-(溶液黄色),故可用作酸碱指示剂。在该水溶液中加入下列物质,能使该指示剂显黄色的是( )
A.盐酸 B.碳酸钠溶液
C.氯化钠溶液 D.过氧化钠
查看答案和解析>>
科目:高中化学 来源: 题型:
对于平衡CO2(g)  CO2(aq) ΔH=-19.75 kJ·mol-1,为增大二氧化碳气体在水中的溶解度,应采用的方法是( )
CO2(aq) ΔH=-19.75 kJ·mol-1,为增大二氧化碳气体在水中的溶解度,应采用的方法是( )
A.升温增压 B.降温减压
C.升温减压 D.降温增压
查看答案和解析>>
科目:高中化学 来源: 题型:
用NA表示阿伏加德罗常数,下列说法正确的是( )
A.0.1mol的白磷(P4)或甲烷中所含的共价键数均为0.4NA
B.标准状况下,一定量的铜与硝酸反应后生成22.4 L NO、NO2、N2O4的混合气体,则被还原的硝酸的分子数大于NA
C.铁做电极电解食盐水,若阴极得到NA个电子,则阳极产生11.2L气体(标准状况下)
D.标准状况下,2.24L Cl2通入足量H2O或NaOH溶液中转移的电子数均为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
硫酸亚锡(SnSO4)是一种重要的能溶于水的硫酸盐,广泛应用于镀锡工业。某研究小组设计SnSO4制备路线如下:
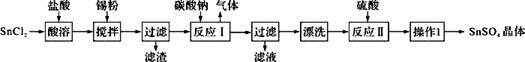
查阅资料:
I、酸性条件下,锡在水溶液中有Sn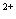 、Sn
、Sn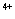 两种主要存在形式,Sn
两种主要存在形式,Sn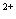 易被氧化。
易被氧化。
Ⅱ、SnCl2易水解生成碱式氯化亚锡[Sn(OH)C1]。
回答下列问题:
(1)操作1的步骤为 、 、过滤、洗涤、干燥。对沉淀进行洗涤的方法是 。
(2)SnCl2粉末需加浓盐酸进行溶解,请结合必要的化学方程式及化学反应原理解释原因: 。
(3)加入Sn粉的作用有两个:①调节溶液pH;② 。
(4)SnSO4还可在酸性条件下用作双氧水的去除剂,发生反应的离子方程式是: 。
(5)该小组通过下列方法测定所用锡粉的纯度(杂质不参与反应):取质量为m g的锡粉溶于稀硫酸中,向生成的SnSO4中加入过量的Fe2(SO4)3溶液,用物质的量浓度为c mol/L的K2Cr2O7标准溶液滴定生成的Fe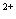 (已知酸性环境下Cr2O
(已知酸性环境下Cr2O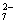 可被还原为Cr
可被还原为Cr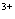 ),共用去K2Cr2O7溶液的体积为V L。则锡粉中锡的质量分数是 。(Sn的摩尔质量为M g/mol,用含m、c、V、M的代数式表示)
),共用去K2Cr2O7溶液的体积为V L。则锡粉中锡的质量分数是 。(Sn的摩尔质量为M g/mol,用含m、c、V、M的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
一种食用香料是乙酸橙花酯,其结构简式如图,关于该有机物的叙述中正确的是
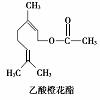 ①属于芳香族化合物②不能发生银镜反应③分子式为C12H20O2
①属于芳香族化合物②不能发生银镜反应③分子式为C12H20O2
④它的同分异构体中可能有酚类⑤1 mol该有机物水解时只能消耗1 mol NaOH
A.②③⑤ B.②③④ C.①②③ D.①④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法不正确的是
| A | B | C | D |
|
| 甲电极上的电极反应为: 2Cl- - 2e- == Cl2↑ | C电极上的电极反应为: O2+2H2O+4e-==4OH- | 总反应的离子方程式为: 2Fe3++Cu==Cu2++ 2Fe2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com