
【题目】K4Fe(CN)6(亚铁氰化钾)可溶于水,不溶于乙醇,在电镀、食品添加剂等方面有广泛应用。以某电镀厂排放的含NaCN废液为主要原料制备K4Fe(CN)6的流程如下。已知:常温下,HCN的Ka=6.2×10-10,回答下列问题:
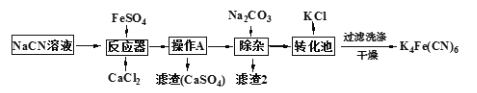
(1)HCN的电离方程式为______________;实验室配制一定浓度的NaCN溶液时,常将NaCN溶解于一定浓度的_______溶液中,加水稀释至指定浓度。
(2)反应器中发生的主要反应的化学方程式为______________。
(3)过滤后,洗涤K4Fe(CN)6使用的试剂为__________。
(4)实验室常用K4[Fe(CN)6]检验Fe3+,生成难溶盐KFe[Fe(CN)6],生成的盐又可用于治疗Ti2SO4中毒,试写出上述治疗Ti2SO4中毒反应的离子方程式为_____________。
(5)一种太阳能电池的工作原理如图,电解质为K3Fe(CN)6和K4Fe(CN)6的混合溶液。
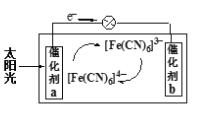
①则K+移向催化剂_________(填“a”或“b”);
②催化剂a表面发生的电极反应为____________。
【答案】 HCN![]() H++CN- NaOH 6NaCN+FeSO4+CaCl2=Na4[Fe(CN)6]+ CaSO4↓+2NaCl 乙醇 KFe[Fe(CN)6]+Ti+
H++CN- NaOH 6NaCN+FeSO4+CaCl2=Na4[Fe(CN)6]+ CaSO4↓+2NaCl 乙醇 KFe[Fe(CN)6]+Ti+![]() TiFe[Fe(CN)6]+K+ b [Fe(CN)6]4--4e-=[Fe(CN)6]3-
TiFe[Fe(CN)6]+K+ b [Fe(CN)6]4--4e-=[Fe(CN)6]3-
【解析】实验目的是合成K4Fe(CN)6,由流程可知,NaCN废液中加入硫酸亚铁、氯化钙,发生6NaCN+FeSO4+CaCl2=Na4Fe(CN)6+CaSO4↓+2NaCl,然后加入碳酸钠溶液可除去过量的Ca2+,经过滤后在滤液中加入KCl可转化生成K4Fe(CN)6,说明K4Fe(CN)6溶解度较小,则
(1)HCN是一元弱酸,电离方程式为HCN![]() H++CN-;NaCN为强碱弱酸盐,溶液中CN-离子水解溶液呈碱性,为抑制水解,在配制溶液时可将其溶解在氢氧化钠溶液中,再加水稀释;(2)NaCN废液中加入硫酸亚铁、氯化钙,发生反应为6NaCN+FeSO4+CaCl2=Na4Fe(CN)6+CaSO4↓+2NaCl;(3)亚铁氰化钾可溶于水,不溶于乙醇,所以选择的洗涤试剂是乙醇;(4)KFe[Fe(CN)6]属于难溶盐,因此治疗Ti2SO4中毒反应的离子方程式为KFe[Fe(CN)6]+Ti+
H++CN-;NaCN为强碱弱酸盐,溶液中CN-离子水解溶液呈碱性,为抑制水解,在配制溶液时可将其溶解在氢氧化钠溶液中,再加水稀释;(2)NaCN废液中加入硫酸亚铁、氯化钙,发生反应为6NaCN+FeSO4+CaCl2=Na4Fe(CN)6+CaSO4↓+2NaCl;(3)亚铁氰化钾可溶于水,不溶于乙醇,所以选择的洗涤试剂是乙醇;(4)KFe[Fe(CN)6]属于难溶盐,因此治疗Ti2SO4中毒反应的离子方程式为KFe[Fe(CN)6]+Ti+![]() TiFe[Fe(CN)6]+K+;(5)①根据电子流向可知a电极是负极,原电池中阳离子向正极移动,则K+移向催化剂b;②原电池的负极发生失去电子的氧化反应,则催化剂a表面发生[Fe(CN)6]4―失去电子的反应,因此发生的电极反应为[Fe(CN)6]4――4e-=[Fe(CN)6]3-。
TiFe[Fe(CN)6]+K+;(5)①根据电子流向可知a电极是负极,原电池中阳离子向正极移动,则K+移向催化剂b;②原电池的负极发生失去电子的氧化反应,则催化剂a表面发生[Fe(CN)6]4―失去电子的反应,因此发生的电极反应为[Fe(CN)6]4――4e-=[Fe(CN)6]3-。


科目:高中化学 来源: 题型:
【题目】将氯化钠、氯化铝、氯化铁、氯化镁五种溶液,通过一步实验就能加以区别,并只用一种试剂,这种试剂是(
A. KSCNB. NaOHC. HClD. BaCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下列实验所选择的装置或仪器(夹持装置已略去)正确的是( )
A | B | C | D | |
实 | 用CCl4提取 | 除去乙醇中的苯酚 | 从KI和I2的固体 | 配制100mL 0.1000 |
装 |
|
|
|
|
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作正确的是( )
A. 加入盐酸以除去硫酸钠中的少量碳酸钠杂质
B. 配制溶液定容时,用胶头滴管滴加蒸馏水至溶液凹液面最低点与刻度线相切
C. 用分液漏斗分离液体时,先放出下层液体后,再放出上层液体
D. 萃取时,将酒精和碘化钾溶液放入分液漏斗中静置
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,不论两种物质以何种比例混合,只要总质量一定,经完全燃烧后,产生的CO2质量不变的是( )
A. 乙烯和苯 B. 乙醇和乙酸 C. 甲醛(HCHO)和葡萄糖 D. 丙烯和丙烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计了种用电解法制取Fe(OH)2的实验装置如图。通电后,溶液中产生白色沉淀,且较长时间不变色。下列说法中正确的是
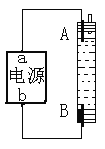
A. 电源中"a"为正极," b"为负极
B. 电解池中的电解液可以是NaOH溶液但不能是NaCl溶液
C. A、B两端都必须使用铁作电极
D. B电极发生的反应:2H2O+2e-=H2↑+2OH-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com