
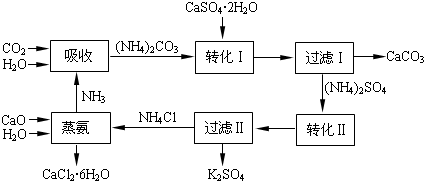
2- 3 |


 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案科目:高中化学 来源: 题型:
| 转化的甲醇的物质的量 |
| 催化剂的物质的量 |

查看答案和解析>>
科目:高中化学 来源: 题型:
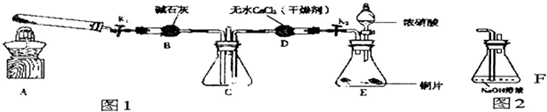
 为确认HCl、H2CO3、H2SiO3的酸性强弱,某学生设计了如图所示的装置,一次实验即可达到目的(不必选其他酸性物质).请据此回答:
为确认HCl、H2CO3、H2SiO3的酸性强弱,某学生设计了如图所示的装置,一次实验即可达到目的(不必选其他酸性物质).请据此回答:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
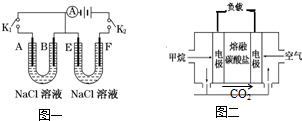 如图一所示,A、F为石墨电极,B、E为铁片电极.按要求回答下列问题:
如图一所示,A、F为石墨电极,B、E为铁片电极.按要求回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
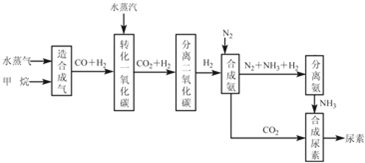
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验 | 现象 | 结论 |
| A | 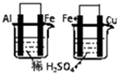 左边烧杯中铁表面有气泡,右边烧杯中铜表面有气泡 | 活动性:Al>Fe>Cu |
| B | 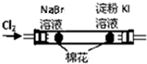 左边棉花变橙色,右边棉花变蓝色 | 氧化性:Cl2>Br2>I2 |
| C | 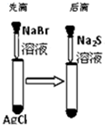 白色固体先变为浅黄色,后变为黑色 | 溶解性:AgCl<AgBr<Ag2S |
| D | 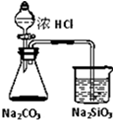 锥形瓶中有气体产生,烧杯中溶液变浑浊 | 酸性:盐酸>碳酸>硅酸 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com