
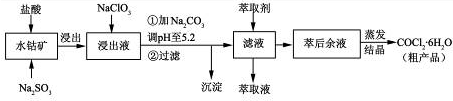
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
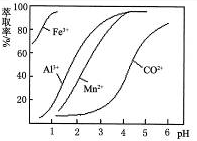
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.2NaCl(熔融)通电2Na+Cl2↑ | B.MgO+H2△Mg+H2O |
| C.Fe3O4+4CO高温3Fe+4CO2 | D.2HgO△2Hg+O2↑ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.它可以通过冷却自来水受热产生的水蒸气而获得 |
| B.它清洁、纯净,长期饮用对健康有益无害 |
| C.它含有人体所需的矿物质和多种维生素 |
| D.它是纯天然饮品,不含任何化学物质 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
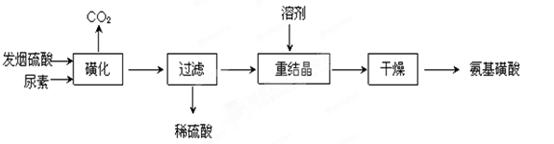
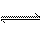 H2NCONHSO3H(s) △H<0
H2NCONHSO3H(s) △H<0 2H2NSO3H + CO2↑
2H2NSO3H + CO2↑查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| | 材料 | 主要化学成分 |
| A. | 陶瓷餐具 | 硅酸盐 |
| B. | 计算机芯片 | 晶体硅 |
| C. | 合金钢 | 铁碳铬硅等合金 |
| D. | 金刚砂 | 二氧化硅 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
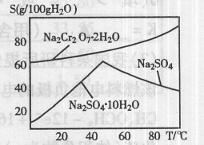
 8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2 。
。
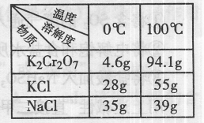
 解
解查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com