
【题目】下列说法正确的是( )
A. SO2和SO3互为同分异构体
B. 液溴和溴蒸气是同素异形体
C. 金刚石和石墨都是由碳原子构成,因此它们是同种物质
D. 乙醇和二甲醚互为同分异构体
 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:
【题目】向密闭容器中充入物质的量浓度均为0.1 molL-1的CH4和CO2,在一定条件下发生反应CH4(g)+CO2(g)![]() 2CO(g)+2H2(g),测得CH4的平衡转化率与温度及压强的关系如图所示。下列说法不正确的是
2CO(g)+2H2(g),测得CH4的平衡转化率与温度及压强的关系如图所示。下列说法不正确的是
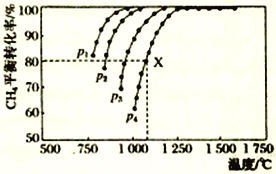
A. 随着温度升高,该反应的平衡常数减小
B. 1100℃,p4条件下,该反应10min时达到平衡点X,则v(CO2)=0.008mol·L-1·min-1
C. p1、p2、p3、p4大小的顺序为p1<p2<p3<p4
D. 平衡时CO与H2的物质的量比为1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将适量铁粉放入Fe2(SO4)3溶液中,完全反应后,溶液中的Fe3+和Fe2+浓度相等.则已经反应的Fe3+和未反应的Fe3+物质的量之比为( )
A.2:3
B.3:2
C.1:2
D.2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)2SO2(g)+O2(g)![]() 2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3(g)的ΔH= —99kJ/mol。
2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3(g)的ΔH= —99kJ/mol。
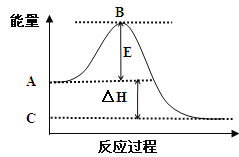 请回答下列问题:
请回答下列问题:
①图中A点表示:
C点表示:
E的大小对该反应的反应热 (填“有”或“无”)影响。
②图中△H= kJ/mol。
(2)由氢气和氧气反应生成1 mol水蒸气,放出241.8 kJ热量(25℃、101 kPa下测得)
①写出该反应的热化学方程式:
②若1 mol水蒸气转化为液态水放热45kJ,则反应H2(g) +1/2O2(g) = H2O( l )的ΔH = kJ/mol。氢气的燃烧热为ΔH = kJ/mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知浓度均为0.1 mol/L的8种溶液:①CH3COONa、②KCl、③NH4Cl 、④NaOH 、⑤Ba(OH)2、⑥HNO3、⑦H2SO4、⑧CH3COOH,其溶液的pH由小到大的顺序是__________________________(填写序号)。
(2)25℃时,若体积为Va、pH=a的某一元强酸溶液与体积为Vb、pH=b的某一元强碱溶液混合,恰好中和。请回答:
若a+b=12,则Va: Vb=________。
若Va<Vb和a=0.5b,则a的取值范围是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家用X射线激光技术观察容器中某反应,各气态反应物粒子在催化剂表面形成化学键过程的示意图如下图所示。下列关于此反应说法错误的是
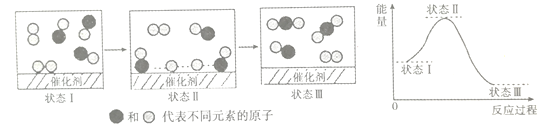
A. 该反应既是化合反应,也是氧化还原反应
B. 该反应是可逆反应,若升高温度,反应物平衡转化率降低
C. 一定条件下达到平衡后,若增大压强,则v(正)、v(逆)均增大,且v(正)>v(逆)
D. 该示意图表明反应物粒子先须断裂所有旧化学键,然后形成新化学键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上CO2用于生产燃料甲醇,既能缓解温室效应,也为能源寻找了新渠道。合成甲醇的反应为:CO2(g)+3H2(g)=CH3OH(g)+H2O(g)。
(1)已知:CO的燃烧热△H=-283.0kJ/mol
2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ/mol
CO(g)+2H2(g) ![]() CH3OH(g) △H=-90.1KJ/mol
CH3OH(g) △H=-90.1KJ/mol
则:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H=___KJ/mol
CH3OH(g)+H2O(g) △H=___KJ/mol
(2)T℃时,测得不同时刻恒容密闭容器中CO2(g)、H2(g)、CH3OH(g)、H2O(g)的浓度变化如下表所示
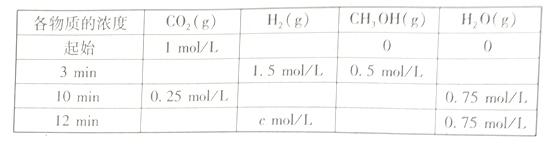
①c=___mol/L,从反应开始到平衡时,CH3OH的平均反应速率v(CH3OH)=__
②下列能说明该反应达到平衡状态的是____________
A.每消耗 1mol CO2的同时生成1 mol CH3OH
B.容器中气体的压强不再改变
C.混合气体的平均相对分子质量不发生变化
D.容器中气体的密度不再改变
(3)在催化剂作用下,若测得甲醇的产率与反应温度、压强的关系如下图所示:
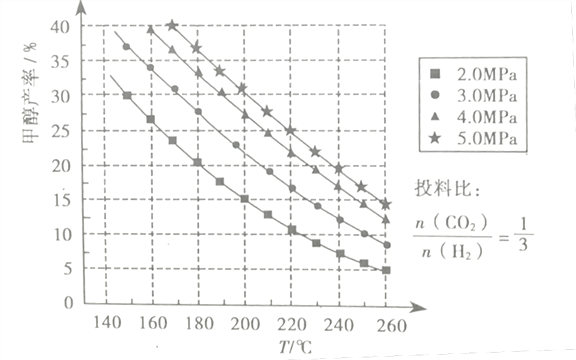
①分析图中数据可知,在220℃、5.0MPa时,CO2的转化率为__将温度降低至140℃、压强减小至2.0MPa,CO2的转化率将___(填“增大”、“减小”或“不变”)
②200℃、2.0MPa时,将amol/LCO2和3amol/LH2充入VL密闭容器中,在催化剂作用下反应达到平衡。根据图中数据计算所得甲醇的质量为___g(用含a的代数式表示)
(4)用NaOH溶液吸收CO2所得饱和碳酸钠溶液可以对废旧电池中的铅膏(主要成分PbSO4)进行脱硫反应。已知Ksp(PbSO4)=1.6x10-8,Ksp(PbCO3)=7.4×10-14,
PbSO4(s)+CO32-(aq) ![]() PbCO3(s)+SO42-(aq),则该反应的平衡常数K=______(保留三位有效数字);若在其溶液中加入少量Pb(NO3)2晶体,则c(SO42-):c(CO32-)的比值将______(填“增大”、“减小、”或“不变”)。
PbCO3(s)+SO42-(aq),则该反应的平衡常数K=______(保留三位有效数字);若在其溶液中加入少量Pb(NO3)2晶体,则c(SO42-):c(CO32-)的比值将______(填“增大”、“减小、”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤气中主要的含硫杂质有H2S以及COS(有机硫),煤气燃烧后含硫杂质会转化成SO2从而引起大气污染,因此煤气中H2S的脱出程度已成为煤气洁净度的一个重要指标。请回答下列问题:
(1)H2S在水溶液中的电离方程式为___________。
(2)脱除煤气中COS的方法有Br2的KOH溶液氧化法、H2还原法、水解法等。
①COS的分子结构与CO2相似,COS的结构式为___________。
②Br2的KOH溶液将COS氧化为硫酸盐的离子方程式为______________。
③已知:H2、COS、H2S、CO的燃烧热依次为285kJ/mol、299kJ/mol、586kJ/mol、283kJ/mol;H2还原COS发生的反应为H2(g)+COS(g)=H2S(g)+CO(g),该反应的ΔH=_________kJ/mol。
④用活性α-Al2O3催化COS水解反应为COS(g)+H2O(g) ![]() CO2(g)+H2S(g) ΔH<0,相同流量且在催化剂表面停留相同时间时,不同温度下COS的转化率(未达到平衡)如图1所示;某温度下,COS的平衡转化率与n(H2O)/n(COS)的关系如图2所示。
CO2(g)+H2S(g) ΔH<0,相同流量且在催化剂表面停留相同时间时,不同温度下COS的转化率(未达到平衡)如图1所示;某温度下,COS的平衡转化率与n(H2O)/n(COS)的关系如图2所示。
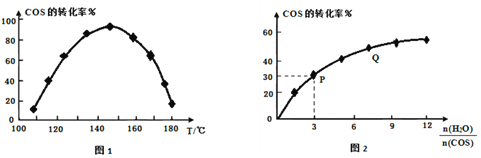
由图1可知,催化剂活性最大时对应的温度约为______,COS的转化率在后期下降的原因是_______________________________________。由图2可知,P点时平衡常数K=______(保留2位有效数字)。Q点转化率高于P点的原因是__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 下列除去括号内杂质的有关操作正确的是
A. 苯(硝基苯):加少量蒸馏水震荡,待分层后分液
B. 乙醇(水):加新制生石灰,蒸馏
C. CO2(HCl、水蒸气):通过盛有碱石灰的干燥管
D. 乙烷(乙烯):通入氢气发生加成反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com