
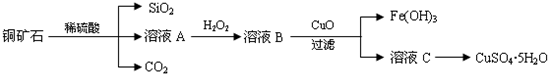
分析 Cu2(OH)2CO3以及Fe、Si的化合物与稀硫酸反应生成硫酸铜、硫酸亚铁、硫酸铁,二氧化硅与稀硫酸不反应,溶液A中加入双氧水具有强氧化性,能把亚铁离子氧化生成铁离子,所以在溶液A中加入H2O2反应的离子方程式是2Fe2++H2O2+2H+=2Fe3++2H2O,溶液B中加入氧化铜调节溶液PH使铁离子全部沉淀,过滤得到滤液,蒸发浓缩,冷却结晶,过滤洗涤得到硫酸铜晶体,
(1)Cu2(OH)2CO3以及Fe、Si的化合物与稀硫酸反应生成硫酸铜、硫酸亚铁、硫酸铁,二氧化硅与稀硫酸不反应,所以溶液中A中除含有Cu2+外,还可能含有的金属离子有Fe2+、Fe3+,验证所含离子所用的试剂是高锰酸钾溶液检验亚铁离子,用硫氰酸钾溶液遇到铁离子形成血红色溶液,
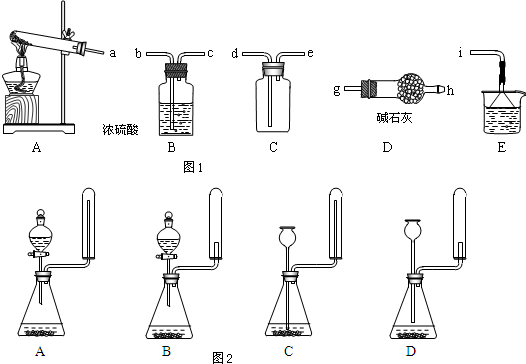
(2)①根据装置图可知,A装置是制备氨气的.由于生成的氨气中含有水蒸气,所以需要干燥,选用碱石灰干燥.氨气的密度小于空气的,且氨气极易溶于水,所以应该用向下排空气法收集,且需要将多余的氨气进行吸收,与i相连的漏斗的作用是防止倒吸.
②用固体氢氧化钠和浓氨水制取少量氨气,因此需要分液漏斗,反应不需要加热,且氨气用向下排空气法收集;
(3)消耗盐酸的物质的量是0.01L×0.5mol/L=0.005mol,则根据方程式NaOH+HCl=NaCl+H2O可知,与盐酸反应的氢氧化钠是0.005mol.氢氧化钠的物质的量是0.1L×0.25mol/L=0.025mol,则与硫酸铜反应的氢氧化钠是0.025mol-0.005mol=0.020mol.则根据方程式2NaOH+CuSO4=Cu(OH)2↓+Na2SO4可知,硫酸铜的物质的量是0.020mol÷2=0.010mol,所以根据原子守恒可知,铜矿石中Cu2(OH)2CO3的物质的量是0.010mol÷2=0.005mol,计算得到质量分数;
解答 解:双氧水具有强氧化性,能把亚铁离子氧化生成铁离子,所以在溶液A中加入H2O2反应的离子方程式是2Fe2++H2O2+2H+=2Fe3++2H2O.
(1)Cu2(OH)2CO3以及Fe、Si的化合物与稀硫酸反应生成硫酸铜、硫酸亚铁、硫酸铁.二氧化硅与稀硫酸不反应,所以溶液A中除含有Cu2+外,还可能含有的金属离子有Fe2+、Fe3+,验证所含离子所用的试剂是高锰酸钾溶液检验亚铁离子,用硫氰酸钾溶液遇到铁离子形成血红色溶液,
故答案为:Fe2+、Fe3+,酸性高锰酸钾溶液、KSCN溶液;
(2)①根据装置图可知,A装置是制备氨气的.由于生成的氨气中含有水蒸气,所以需要干燥,选用碱石灰干燥.氨气的密度小于空气的,且氨气极易溶于水,所以应该用向下排空气法收集,且需要将多余的氨气进行吸收,因此正确的操作顺序是a→g、h→e、d→i;氨气极易溶于水,因此与i相连的漏斗的作用是防止倒吸,
故答案为:ghed,防止倒吸;
②用固体氢氧化钠和浓氨水制取少量氨气,因此需要分液漏斗.反应不需要加热,且氨气用向下排空气法收集,所以正确的答案选A,
故答案为:A;
(3)消耗盐酸的物质的量是0.01L×0.5mol/L=0.005mol,则根据方程式NaOH+HCl=NaCl+H2O可知,与盐酸反应的氢氧化钠是0.005mol.氢氧化钠的物质的量是0.1L×0.25mol/L=0.025mol,则与硫酸铜反应的氢氧化钠是0.025mol-0.005mol=0.020mol.则根据方程式2NaOH+CuSO4=Cu(OH)2↓+Na2SO4可知,硫酸铜的物质的量是0.020mol÷2=0.010mol,所以根据原子守恒可知,铜矿石中Cu2(OH)2CO3的物质的量是0.010mol÷2=0.005mol,所以Cu2(OH)2CO3质量分数为$\frac{0.005mol×222g/mol}{1.25g}$×100%=88.8%.
故答案为:88.8%.
点评 本题考查了混合物质的分离提纯,实验过程分析判断,注意仪器的应用和含量的计算,掌握基础是解题关键,题目难度中等.


 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案科目:高中化学 来源: 题型:选择题

| A. | 该物质属于芳香族化合物 | B. | 它的分子式是C16H10N2O2 | ||
| C. | 靛蓝完全燃烧生成二氧化碳和水 | D. | 它是不饱和的有机物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钢铁因含杂质而容易发生电化学腐蚀,所以合金都不耐腐蚀 | |
| B. | 原电池反应是导致金属腐蚀的主要原因,故不能用原电池原理来减缓金属的腐蚀 | |
| C. | 钢铁电化学腐蚀的两种类型主要区别在于水膜的酸性不同,引起的正极反应不同 | |
| D. | 无论哪种类型的腐蚀,其实质都是金属被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 金属离子 | 完全沉淀pH |
| Fe2+ | 9.7 |
| Mg2+ | 12.4 |
| Fe3+ | 3.2 |
| Al3+ | 5.2 |

查看答案和解析>>
科目:高中化学 来源: 题型:填空题

| 沉淀物 | Fe(OH)2 | Fe(OH)3 | Al (OH)3 |
| 开始沉淀时的pH | 7.0 | 1.9 | 3.4 |
| 完全沉淀时的pH | 9.0 | 3.2 | 4.7 |
| 实验操作 | 现象 | 结论 |
| 取适量产品于洁净烧杯中,加入适量蒸馏水,充分搅拌,静置,滤去沉淀. | 得黄棕色溶液 | |
| 取少量溶液于试管中,滴加溶液 ①0.05mol/L酸性高锰酸钾; | ②溶液不褪色; | 溶液中不含Fe2+ |
| 取少量溶液于试管中,滴加0.1 mol/L BaCl2溶液,再滴加20% HNO3溶液 | ③产生白色沉淀; | 溶液中含有SO${\;}_{4}^{2-}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com