
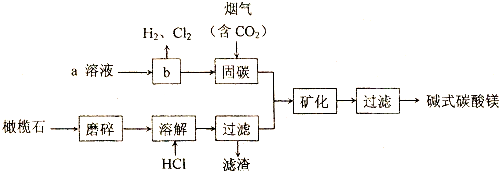

分析 (1)硅酸盐是构成地壳岩石的主要成分,化学上常用二氧化硅和氧化物的形式表示其组成,例如:镁橄榄石(Mg2SiO4)常以2MgO•SiO2表示,可看出改写中要保证原子总数,化合价不变,按化合价分别写出氧化物的化学式,如有多个原子,在前面加上系数,使之成为倍数,据此进行分析解答;
(2)依据影响反应速率因素分析判断,升温、增大浓度,增大接触面积会提高反应速率;
(3)大多数放热的、熵增加的过程有利于反应的自发进行;
(4)工业上用氯电解饱和食盐水会获得烧碱;
(5)根据能和二氧化碳之间反应的物质能来固定二氧化碳来回答;
(6)温度对化学反应平衡移动的影响知识来回答;
(7)氯离子的检验用硝酸酸化的硝酸;
解答 解:(1)根据硅酸盐写成氧化物的规律,Mg9FeSi5O20用氧化物的形式可表示为9MgO•FeO•5SiO2,
故答案为:9MgO•FeO•5SiO2;
(2)为提高HC1溶液溶解橄榄石的效率,可采取的措施适当提高温度,适当增大HCl溶液的浓度或搅拌或增大接触面积等,
故答案为:适当提高温度,适当增大HCl溶液的浓度或搅拌或增大接触面积等;
(3)反应NaOH(aq)+CO2(g)=NaHCO3(aq)是一个熵减小的反应,要使其自发进行,则必须△H<0,故答案为:△H<0;
(4)根据流程图,固碳时主要反应的方程式为NaOH(aq)+CO2 (g)=NaHCO3 (aq),工业上用氯电解饱和食盐水会获得烧碱、氯气和氢气,a溶液为氯化钠溶液,流程b的化学反应方程式为:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑,
故答案为:NaCl溶液,2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑;
(5)所给的物质中,H2NCH2COONa和(NH4)2CO3可以和二氧化碳之间反应,能用作“固碳”的试剂,故答案为:bc;
(6)1 图中所示数据以及曲线变化知道,20min后,溶解达到平衡,而该反应是放热,升温,平衡逆向移动,则溶解效率降低,
故答案为:120min后,溶解达到平衡,而反应放热,升温平衡逆向移动,溶解效率降低;
(7)判断产品洗净只需要检验洗涤液中不含有氯离子即可,氯离子的检验用硝酸酸化的硝酸银,操作是:取少量最后一次的洗涤液,加硝酸酸化的硝酸银溶液,如无沉淀产生,则已洗净,
故答案为:取少量最后一次的洗涤液,加硝酸酸化的硝酸银溶液,如无沉淀产生,则已洗净.
点评 本题是一道化学和生产结合的工艺流程题,是现在考试的热点,注意知识的迁移和灵活应用是解题的关键,难度不大.


 计算高手系列答案
计算高手系列答案科目:高中化学 来源:2016-2017学年江西省高二上10月月考化学试卷(解析版) 题型:填空题
合成氨是人类科学技术上的一项重大突破,其反应原理为N2(g)+3H2(g)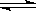 2NH3(g) ΔH=-92.4 kJ·mol-1。一种工业合成氨的简式流程图如下:
2NH3(g) ΔH=-92.4 kJ·mol-1。一种工业合成氨的简式流程图如下:
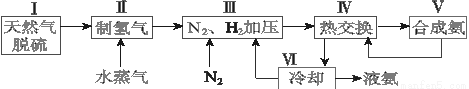
(1)天然气中的H2S杂质常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式:_______________。
(2)步骤Ⅱ中制氢气的原理如下:
①CH4(g)+H2O(g)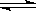 CO(g)+3H2(g) ΔH=+206.4 kJ·mol-1
CO(g)+3H2(g) ΔH=+206.4 kJ·mol-1
②CO(g)+H2O(g)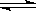 CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
对于反应①,一定可以提高平衡体系中H2的百分含量,又能加快反应速率的措施是 __。
利用反应②,将CO进一步转化,可提高H2的产量。若1 mol CO和H2的混合气体(CO的体积分数为20%)与H2O反应,得到1.18 mol CO、CO2和H2的混合气体,则CO的转化率为____________。
(3)如图表示500 ℃、60.0 MPa条件下,原料气投料比与平衡时NH3体积分数的关系。根据图中a点数据计算N2的平衡体积分数:______________。
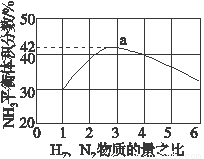
(4)上述流程图中,使合成氨放出的能量得到充分利用的主要步骤是(填序号)_____________。简述本流程中提高合成氨原料总转化率的方法:_________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省高二上月考一化学卷(解析版) 题型:计算题
磷在氧气中燃烧,可能生成两种固态氧化物。6.2 g的单质磷(P)在6.4 g氧气中燃烧,至反应物耗尽,并放出a kJ热量。
(1 )通过计算确定反应产物的组成(用化学式表示)是 ,其相应的质量(g)为 。
)通过计算确定反应产物的组成(用化学式表示)是 ,其相应的质量(g)为 。
(2)已知单质磷的燃烧热为b kJ/mol,则1mol P与O2反应生成固态P2O3的反应热ΔH= 。
(3)写出1mol P与O2反应生成固态P2O3的热化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
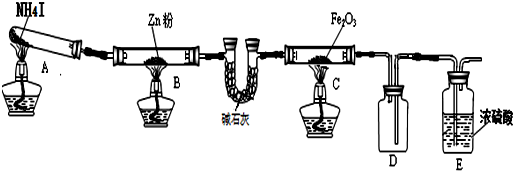
| 步骤 | 操作 | 甲组现象 | 乙组现象 |
| 1 | 取黑色粉末加入稀盐酸 | 溶解,无气泡 | 溶解,有气泡 |
| 2 | 取步骤1中溶液,滴加KSCN溶液 | 变红 | 无明显变化 |
| 3 | 向步骤2溶液中滴加新制氯水 | 红色先变深后褪去 | 先变红后也褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 仅含有碳和氢两种元素的化合物称为烃 | |
| B. | 凡是分子里含碳元素的化合物都属于烃 | |
| C. | 甲烷可以使酸性高锰酸钾溶液褪色 | |
| D. | 有机化合物分子中碳原子之间只有单键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 化学反应及离子方程式 | 评价 |
| A | AlCl3溶液中加入过量氨水: Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | 错误,铝元素的产物应该是AlO2- |
| B | 过量氯气通入溴化亚铁溶液中: 3Cl2+2Fe2++4Br-═6Cl-+2Fe3++2Br2 | 正确 |
| C | 用氨水吸收过量二氧化硫: 2NH3•H2O+SO2═2NH4++SO32-十H2O | 正确 |
| D | 氯化铵溶于水: NH4++2H2O═H3O++NH3•H2O | 错误,氯化铵溶解于水是物理变化,不能写离子方程式 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com