
【题目】某小组研究了铜片与![]() 反应的速率,实现现象记录如下表。
反应的速率,实现现象记录如下表。
实验 | 时间段 | 现象 |
|
| 铜片表面出现极少气泡 |
| 铜片表面产生较多气泡,溶液呈很浅的蓝色 | |
| 铜片表面均匀冒出大量气泡 | |
| 铜片表面产生较少气泡,溶液蓝色明显变深,液面上方呈浅棕色 |
为探究影响该反应速率的主要因素,小组进行如下实验。
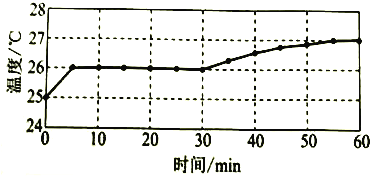
实验I:监测上述反应过程中溶液温度的变化,所得曲线如下图。
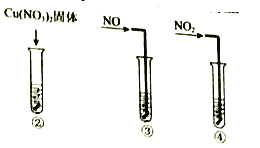
实验II:②-④试管中加入大小、形状相同的铜片和相同体积、 ![]() 。结果显示:
。结果显示:![]() 对
对![]() 和
和![]() 反应速率的影响均不明显,
反应速率的影响均不明显,![]() 能明显加快该反应的速率。
能明显加快该反应的速率。
实验III:在试管中加入铜片和![]() ,当产生气泡较快时,取少量反应液于试管中,检验后发现其中含有
,当产生气泡较快时,取少量反应液于试管中,检验后发现其中含有![]() 。
。
(1)根据表格中的现象,描述该反应的速率随时间的变化情况:____________。
(2)实验![]() 的结论:温度升高___________(填“是”或“不是”)反应速率加快的主要原因。
的结论:温度升高___________(填“是”或“不是”)反应速率加快的主要原因。
(3)实验II的目的是:__________
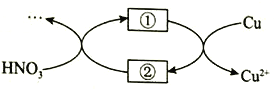
(4)小组同学查阅资料后推测:该反应由于生成某中间产物而加快了反应速率。请结合实验II、III,在下图方框内填入相应的微粒符号①____②_____,以补全催化机理。
(5)为验证(4)中猜想,还需补充一个实验:__________(请写出操作和现象)。
【答案】反应速率先变快后变慢 不是 检验![]() 能否加快铜和硝酸反应的速率
能否加快铜和硝酸反应的速率 ![]()
![]() 在试管
在试管![]() 中均加入相同的铜片和等体积的
中均加入相同的铜片和等体积的![]() 硝酸,向
硝酸,向![]() 中加入
中加入![]() 固体,产生气泡的速率
固体,产生气泡的速率![]() 比
比![]() 快。
快。
【解析】
(1)表格中的现象变化:极少气泡较多气泡大量气泡较少气泡;
(2)5—30min,温度不变,但是15—30min,反应速率加快;
(3)实验II结论:![]() 对
对![]() 和
和![]() 反应速率的影响均不明显,
反应速率的影响均不明显,![]() 能明显加快该反应的速率;
能明显加快该反应的速率;
(4)结合实验II与实验III,实验II:可知![]() 能明显加快该反应的速率。实验III:发现其中含有
能明显加快该反应的速率。实验III:发现其中含有![]() 。再根据化合价的升降可判断;
。再根据化合价的升降可判断;
(5)中间产物为![]() ;
;
(1)根据表格中的气泡多少的现象,可知该反应的速率随时间的变化情况:反应速率先变快后变慢;
(2)由分析可知,温度不变时反应速率却加快,故温度升高不是反应速率加快的主要原因;
(3)由分析可知,实验II的目的是:检验![]() 能否加快铜和硝酸反应的速率;
能否加快铜和硝酸反应的速率;
(4)Cu Cu2+,化合价升高,则①②的化合价降低,故①为![]() ,②为
,②为![]() ;
;
(5)验证中间产物![]() 加快了反应速率,则可以在试管
加快了反应速率,则可以在试管![]() 中均加入相同的铜片和等体积的
中均加入相同的铜片和等体积的![]() 硝酸,向
硝酸,向![]() 中加入
中加入![]() 固体,产生气泡的速率
固体,产生气泡的速率![]() 比
比![]() 快。
快。


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】下列有关说法不正确的是(均不考虑立体异构)
A. 分子式为C4H10O且与Na反应生成氢气的化合物有4种
B. ![]() 的二溴代物的数目有6种
的二溴代物的数目有6种
C. 苯环上有两个取代基丙基和丁基的同分异构体数目有8种
D. 分子式为C5H10O2且能发生水解反应的化合物有9种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过碳酸钠(Na2CO4)是一种很好的供氧剂,与稀盐酸发生反应的化学方程式为
2Na2CO4 + 4HCl = 4NaCl + 2CO2↑ + O2↑ + 2H2O市售过碳酸钠中一般都含有碳酸钠,为测定某过碳酸钠样品(只含Na2CO4和Na2CO3)的纯度,某化学兴趣小组采用以下方案实施:按如图组装好实验装置,Q为一可鼓胀收缩的塑料气袋(该气袋耐酸碱腐蚀),取适量样品于其中,打开分液漏斗活塞,将足量稀盐酸滴入气袋中至充分反应。

(1)过碳酸钠的化学式也可表示为 aNa2O2· bNa2CO3,请写出Na2O2的电子式:__________________
(2)仪器B的名称为________,导管A的作用是_________________________________________
(3)该实验共需测定两个数据,首先需测定反应所生成的气体的总体积,故滴加稀盐酸前必须关闭___和___并打开____(均填“K1”、“K2”或“K3”)
(4)其次用量筒Ⅱ测定混合气体中某种成分的体积,则 B中装的固体试剂名称为_________,具体测定过程如下:当Q中反应停止后,使 K1 和 K3 处于关闭状态, K2处于打开状态,再缓缓打开K1即可。
(5)实验结束时,装置内的气体同温同压,测得量筒I中有x mL水,量筒Ⅱ中收集到了y mL气体,则样品中过碳酸钠的质量分数是_____________(用含有x、y的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2Cu(IO3)2+24KI+12H2SO4=2CuI![]() (碘化亚铜)+13I2+12K2SO4+12H2O,下列说法正确的是 ( )
(碘化亚铜)+13I2+12K2SO4+12H2O,下列说法正确的是 ( )
A.Cu(IO3)2作氧化剂,Cu(IO3)2中只有碘元素被还原
B.CuI既是氧化产物又是还原产物
C.每生成1mol CuI,有11mol KI发生氧化反应
D.每转移1.1mol电子,有0.2mol IO3-被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海带中含有丰富的碘。为了从海带中提取碘,某研究性学习小组设计并进行了以下实验(苯,一种不溶于水,密度比水小的液体):

请填写下列空白:
(1)步骤①灼烧海带时,除需要三脚架外,还需要用到的实验仪器是_______(从下列仪器中选出所需的仪器,用标号字母填写在空白处)。
A.烧杯 B.坩埚 C.表面皿 D.泥三角 E.酒精灯 F.干燥器
(2)步骤③的实验操作名称是_______;步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,该步骤的实验操作名称是_______。
(3)步骤⑤是萃取、分液,某学生选择用苯来提取碘的理由是_______。在分液操作中,应充分振荡,然后静置,待分层后______(填标号),以下略。
A.直接将含碘苯溶液从分液漏斗上口倒出
B.直接将含碘苯溶液从分液漏斗下口放出
C.先将水层从分液漏斗的下口放出,再将含碘苯溶液从下口放出
D.先将水层从分液漏斗的下口放出,再将含碘苯溶液从上口倒出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A(g)+B(g) ![]() C(g)+D(g)过程中的能量变化如图所示,回答下列问题。
C(g)+D(g)过程中的能量变化如图所示,回答下列问题。
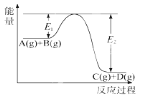
(1)该反应是________反应(填“吸热”、“放热”)。
(2)当反应达到平衡时,升高温度,A的转化率________(填“增大”、“减小”或“不变”),原因是________。
(3)反应体系中加入催化剂对反应热是否有影响_______(填“有”、“无”)。
(4)在反应体系中加入催化剂,反应速率增大,此时E1______,E2_______(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】处理含氰![]() 废水可以用以下两种方法:
废水可以用以下两种方法:
Ⅰ:![]() (未配平),其中A为参与大气循环的气体
(未配平),其中A为参与大气循环的气体
Ⅱ:①![]() (未配平)
(未配平)
②![]() 下列说法正确的是( )
下列说法正确的是( )
A. ![]() 和
和![]() 的电子式分别为
的电子式分别为![]()
![]()
B. 方法Ⅰ中,每生成![]() ,转移
,转移![]() 个电子
个电子
C. 方法Ⅱ中,![]() 是反应②的氧化产物
是反应②的氧化产物
D. 方法Ⅱ的反应①中,![]() 与
与![]() 的物质的量之比为1∶1
的物质的量之比为1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数,下列说法正确的是
A. 28g乙烯所含共用电子对数目为2NA
B. 14g乙烯、丙烯、丁烯的混合气体中,所含原子数为3NA
C. 标准状况下,11.2L氟化氢所含分子数为0.5NA
D. 1.5g甲基所含电子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的值,下列有关叙述错误的是
A. 56 g铁粉在1mol氯气中充分燃烧,失去的电子数为3NA
B. 标准状况下22.4L CH4和C2H4的混合气体所含氢原子数为4NA
C. 常温常压下,3.4gNH3中含N—H键数目为0.6NA
D. 1mol 固体NaHSO4含有的阴阳离子总数为2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com