
【题目】工业废水中常含有一定量的 CrO72﹣和 CrO42﹣ , 它们会对生态系统产生很大的伤害,工业上对废水处理的工艺流程如下:CrO42﹣ ![]() Cr2O72﹣→
Cr2O72﹣→ ![]() Cr3+→
Cr3+→ ![]() Cr(OH)3↓
Cr(OH)3↓
(1)CrO42﹣中 Cr 的化合价;Cr3+的核外电子排布式为 .
(2)写出第①步发生的离子反应方程式;若常温下,减 小平衡体系的 pH 至 pH=2,则溶液趋向于显色(.
(3)第②步中,还原 0.01mol Cr2O72﹣离子,需要mol 的 FeSO47H2O.
(4)已知 Cr(OH)3 在溶液中存在以下平衡:H++CrO2﹣+H2OCr(OH)3Cr3++3OH
下列有关说法中正确的是
a.加 HCl 则平衡均向右移动,则生成 Cr3+盐
b.按照物质分类 Cr(OH)3是两性氢氧化物,属于弱电解质
c.Cr3+盐中逐滴加入 NaOH 溶液,先产生沉淀,后沉淀消失
d.Cr(OH)3 饱和溶液中一定有 c(H+ )=c(OH﹣ )
【答案】
(1)+6,[Ar]3d3
(2)2CrO42﹣(黄色)+2H+?Cr2O72﹣(橙色)+H2O,橙
(3)0.06
(4)abc
【解析】解:(1)Cr2O72﹣中O的化合价为﹣2价,由离子中元素化合价的代数和等于所带电荷数可得,Cr的化合价为+6,Cr所含质子数为24,原子核外电子数为24,Cr3+的核外有21个电子,电子排布式为[Ar]3d3,
所以答案是:+6;[Ar]3d3;
(2)第①步发生2CrO42﹣(黄色)+2H+Cr2O72﹣(橙色)+H2O,pH=2呈酸性,平衡正向移动,溶液呈橙色,
所以答案是:2CrO42﹣(黄色)+2H+Cr2O72﹣(橙色)+H2O;橙;
(3)还原Cr2O72﹣离子可生成Cr3+,还原 0.01mol Cr2O72﹣离子,转移0.06mol电子,Fe元素化合价由+2价变化为+3价,则需要0.06molFeSO47H2O,
所以答案是:0.06;
(4)a.加 HCl,氢离子浓度增大,与氢氧根离子反应,则平衡均向右移动,则生成 Cr3+盐,故a正确;
b.按照物质分类 Cr(OH)3是两性氢氧化物,由电离方程式可知不能完全电子,则属于弱电解质,故b正确;
c.Cr3+盐中逐滴加入 NaOH 溶液,先产生Cr(OH)3沉淀,后生成CrO2﹣,沉淀消失,故c正确;
d.Cr(OH)3 饱和溶液存在Cr(OH)3Cr3++3OH﹣,为弱碱,溶液呈碱性,故d错误.
所以答案是:abc.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某原电池装置如图所示。

(1)其负极是_________(填“Zn”或“Cu”),发生的是__________(填“氧化”或“还原”)反应,电极反应式为___________________ 。
(2)正极上的现象是________________________________________。
(3)电子由_______________(填“锌片”或“铜片”)沿导线流出。
(4)电池总反应的离子方程式是_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下电子排布式是基态原子的电子排布的是( )
①1s12s1 ②1s22s12p1 ③1s22s22p63s2 ④1s22s22p63s23p1
A. ①② B. ①③ C. ②③ D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知,CO 的毒性表现在 CO 与血红蛋白(Hb)结合成 HbCO,使血红蛋白 失去输送 O2 功能.CO 进入血液后有如下平衡:CO+HbO2O2+HbCO,已知在人体体温37℃下,该平衡常数为 220.试回答:
(1)煤气中毒病人,可以通过进入高压氧舱的方法来救治,请用化学平衡的原理加以 说明:
(2)抽烟时,进入肺部的空气中 c(CO)=10﹣6mol/L,c(O )=10﹣2mol/L,则 c(HbCO)为 c(HbO2)的倍.
(3)已知当血液中 c(HbCO)的比值大于 0.02 时,人的智力会很快受到损伤,为避免c(HbO2 )
人的智力受到损伤,c(O2)与 c(CO)的比值应大于 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】积极保护生态环境可实现人与自然的和谐共处.
①下列做法会加剧温室效应的是(填字母).
a.植树造林 b.燃煤供暖 c.风力发电
②下列防治“白色污染”的正确方法是(填字母).
a.使用可降解塑料 b.露天焚烧废弃塑料 c.直接填埋废弃塑料
③为减轻大气污染,多个城市已禁止燃放烟花爆竹.“禁止燃放烟花爆竹”的标识是(填字母).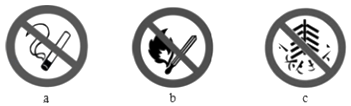
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙炔(C2H2)是制造草酸、乙醛、醋酸等有机化合物的基本原料。
(1)某小组同学以电石(主要成分为CaC2,含少量CaS及Ca3P2等杂质)为原料,利用下图所示实验装置(夹持装置略去,下同)制备C2H2。

①仪器a的名称为__________________________。
②CaC2的电子式为________________________________。
③装置B中的NaClO溶液能将H2S、PH3氧化为硫酸、磷酸,本身被还原为NaCl。其中PH3被氧化的离子方程式为________________________________。
(2)该小组同学通过查阅文献资料得知:用Hg(NO3)2作催化剂时,浓硝酸能将乙炔气体氧化为草酸(H2C2O4),实验装置如下图所示。

①装置E的作用是_________________________________________。
②装置D中生成H2C2O4的化学方程式为_________________________________。
③装置D中锥形瓶内的液体经过___________(填操作名称)、洗涤、干燥等步骤得到H2C2O4·2H2O晶体。
(3)该小组同学测定了晶体中H2C2O4·2H2O的质量分数,实验步骤如下:
i.准确称取mg晶体,加入适量的蒸馏水溶解,再加入少量稀硫酸;
ii.将i所得溶液用c mol/LKMnO4标准溶液进行滴定,滴定时KMnO4被还原为Mn2+,滴定至终点时消耗标准溶液VmL。
①滴定过程中发现褪色速率先慢后明显加快,除反应放热外,还可能的原因是____________。
②晶体中H2C2O4·2H2O的质量分数为_________(用含m、c、V的式子表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com