
����Ŀ����֪ij�¶��£�Ksp��AgCl��=1.56��10��10 mol2L��2 �� Ksp��Ag2CrO4��=1.12��10��12 mol3L��3 �� ����������ȷ���ǣ�������
A.���Ȼ�������Һ�м����Ȼ�����Һ���Ȼ�����Ksp��С
B.��2.0��10��4molL��1��K2CrO4��Һ�м���������2.0��10��4 molL��1 AgNO3��Һ������Ag2CrO4��������
C.��һ������AgCl��Ag2CrO4����������������ˮ�У�����ܽ���ã��ϲ���Һ��Cl�������ʵ���Ũ�����
D.��0.001 molL��1��AgNO3��Һ��ε���0.001 molL��1��KCl��0.001 molL��1��K2CrO4�Ļ����Һ�У����Ȳ���AgCl����
���𰸡�D
��������A��AgCl��Kspֻ���¶��йأ���AgCl����Һ�м����Ȼ�����Һ����Ȼƽ�����淽���ƶ�����Ksp���䣬����A����
B��Q= ![]() =
= ![]() =1.0��10��12��Ksp��Ag2CrO4��=1.12��10��12 mol3L��3 �� ����û�г������ɣ�����B����
=1.0��10��12��Ksp��Ag2CrO4��=1.12��10��12 mol3L��3 �� ����û�г������ɣ�����B����
C��AgCl��Ag2CrO4����������������ˮ�У�AgCl��Ag2CrO4������������ӣ�����������Ũ���������C����
D������Ksp��AgCl����Ksp��Ag2CrO4������Cl����ʼ����ʱc��Ag+��= ![]() =1.8��10��7mol/L����CrO42����ʼ����ʱc��Ag+��=
=1.8��10��7mol/L����CrO42����ʼ����ʱc��Ag+��= ![]() =4.36��10��5 mol/L�������Ȳ���AgCl����������D��ȷ������ѡD��
=4.36��10��5 mol/L�������Ȳ���AgCl����������D��ȷ������ѡD��


 �ο�����������100��ϵ�д�
�ο�����������100��ϵ�д� �Űٷֿ�ʱ����ϵ�д�
�Űٷֿ�ʱ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������CO2ͨ��KOH��Ca��OH��2�Ļ����Һ�У����ɳ�����������m����ͨ��CO2�����V���Ĺ�ϵ��ͼ��ʾ��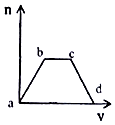
��1��ab�η��������ӷ�Ӧ����ʽΪ ��
��2��bc�����η����������ӷ�Ӧ�������� �� ����� ��
��3��cd�η��������ӷ�Ӧ����ʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڱ�״���£���ͬ��������������������ʵ�������С����
A. CH4 B. N2 C. O2 D. C2H2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и����ʵ����ʱȽ���ȷ����
A. ���ԣ�H2SiO3 > H3PO4B. �����ԣ�Cl2 > F2
C. �ȶ��ԣ�H2S > HFD. ���ԣ�NaOH > Al(OH)3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ںϽ������������ȷ����
A. �Ͻ���۷е�һ���������ǵĸ��ɷֽ���Ҫ��
B. �Ͻ��Ӳ�ȿ��Ա�ԭ��������,��ѧ����Ҳ���ܺ�ԭ�ɷֽ�����ͬ
C. �ǽ����ͽ���֮��Ҳ�����γɺϽ�
D. �Ͻ����;�ȴ���������;���㡣
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Խ����У���MnSO4��Һ��μӣ�NH4��2S2O8����������泥���Һ�ᷢ�����·�Ӧ��Mn2++S2O82��+H2O��MnO4��+SO42��+H+ �� ����˵������ȷ���ǣ� ��
A.�������ø÷�Ӧ����Mn2+
B.�����ԱȽϣ�S2O82����MnO4��
C.�÷�Ӧ�����Խ��ʿ���Ϊ����
D.����0.1mol�����������ɣ���ת�Ƶ���0.5mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʵ�ˮ��Һ�����ԣ�����ʹˮ�ĵ���ƽ�����������ƶ����ǣ�
A. Na2CO3 B. NH4Cl C. H2SO4 D. NaHCO3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и��������У�ǰ�߸պ��Ǻ����������ǣ�������
A.2 molˮ��Ħ��������1 molˮ��Ħ������
B.200 mL 1 mol/L�Ȼ�����Һ��c��Cl������100 mL 2 mol/L�Ȼ�����Һ��c��Cl����
C.64 g������������ԭ�����ͱ�״����22.4 Lһ����̼����ԭ����
D.20%NaOH��Һ��NaOH�����ʵ���Ũ�Ⱥ�10%NaOH��Һ��NaOH�����ʵ���Ũ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ǧ���صĵ缫����Ǧ�࣬��Ҫ��PbO��PbO2��PbSO4�������Ʊ����ȶ������λ�����Ǧ����ɿɱ�ʾΪ3PbOPbSO4H2O������ʵ���������£� 
��1������X����ѭ�����ã��������� �� ���һ�ι���֮����Ҫϴ�ӣ��������λ�����Ǧ�Ƿ�ϴ���ķ����� ��
��2������ҺA����ȡ��һ�ֺ��ᾧˮ�����θ���Ʒ��������þ����нᾧˮ�ĺ���������Ĺ����β�����������������������ʯ�������������ȣ�
��3�������в�ֱ������H2SO4��Һ��PbO��PbCO3��Ӧ��ȡPbSO4 �� ԭ������� ��
��4���������λ�����Ǧ�����ӷ�Ӧ����ʽΪ ��
��5����Ǧ�ཬҺ�м���Na2SO4��Һ��Ŀ���ǽ����е�PbO2��ԭΪPbO����ʵ������ȡǦ�������Ϊ47.8g������PbO2����������Ϊ15.0%����Ҫ��PbO2ȫ����ԭ���������mL 1.0molL��lNa2SO3��Һ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com