
【题目】(1)汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下:
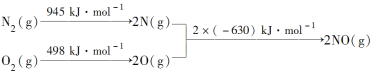
写出该反应的热化学方程式:____。
(2)科学家制造出一种使用固体电解质的燃料电池,其效率更高,可用于航空航天。如图1所示装置中,以稀土金属材料作惰性电极,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导正极生成的O2-(O2+4e-=2O2-)。
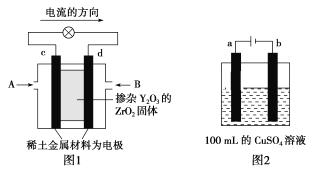
①c电极的名称为___,d电极上的电极反应式为____。
②如图2所示电解100mL0.5mol·L-1CuSO4溶液,a电极上的电极反应式为___。若要使电解质溶液恢复到电解前的状态,可加入___(填字母)。
a.CuO b.Cu(OH)2 c.CuCO3 d.Cu2(OH)2CO3
(3)利用反应2Cu+O2+2H2SO4=2CuSO4+2H2O可制备CuSO4,若将该反应设计为原电池,其正极电极反应式为____。
(4)人工肾脏可采用间接电化学方法除去代谢产物中的尿素[CO(NH2)2],原理如图。

①电源的负极为____(填“A”或“B”)。
②阳极室中发生的反应依次为___。
③电解结束后,阴极室溶液的pH与电解前相比将___(填“增大”“减小”或“不变”);若两极共收集到气体13.44L(标准状况),则除去的尿素为___g(忽略气体的溶解)。
(5)化学镀的原理是利用化学反应生成金属单质沉积在镀件表面形成镀层。
①若用铜盐进行化学镀铜,应选用____(填“氧化剂”或“还原剂”)与之反应。
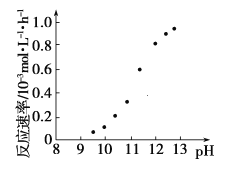
②某化学镀铜的反应速率随镀液pH变化如图所示。该镀铜过程中,镀液pH控制在12.5左右。据图中信息,给出使反应停止的方法:___。
【答案】N2(g)+O2(g)=2NO(g) ΔH=+183kJ·mol-1 正极 CH4-8e-+4O2-=CO2+2H2O 4OH--4e-=2H2O+O2↑ ac O2+4H++4e-=2H2O B 2Cl--2e-=Cl2↑、CO(NH2)2+3Cl2+H2O=N2+CO2+6HCl 不变 7.2 还原剂 调节溶液pH在8~9之间
【解析】
(1)反应物断裂化学键所需要吸收的总能量减去生成物形成化学键释放的总能量即为焓变;
(2)①图1是原电池,依据电流流向是从正极流向负极,c电极为正极,氧气得到电子发生还原反应,d电极为电池负极,甲烷失电子发生还原反应,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导正极生成的O2-离子,由此可以得出电极方程式;
②图2所示电解100mL0.5molL-1CuSO4溶液,发生的电解池反应为:2CuSO4+2H2O![]() 2Cu+O2↑+2H2SO4,与电源正极相连的为阳极,溶液中氢氧根离子失去电子发生氧化反应;电解过程中CuSO4溶液每损失2个Cu原子,就损失2个 O原子;
2Cu+O2↑+2H2SO4,与电源正极相连的为阳极,溶液中氢氧根离子失去电子发生氧化反应;电解过程中CuSO4溶液每损失2个Cu原子,就损失2个 O原子;
(3)该反应中Cu元素化合价由0价变为+2价、O元素化合价由0价变为-2价,要将该反应设计成原电池,Cu作负极,正极上氧气得电子发生还原反应,因为在酸性条件下,所以氧气得电子和氢离子反应生成水;
(4)①由图可知,左室电极产物为Cl2,发生氧化反应,故A为电源的正极,右室电解产物H2,发生还原反应,故B为电源的负极;
②由图可知,阳极室首先是氯离子放电生成氯气,氯气再氧化尿素生成氮气、二氧化碳,同时会生成HCl,阳极室中发生的反应依次为:2Cl--2e-=Cl2↑、CO(NH2)2+3Cl2+H2O=N2+CO2+6HCl;
③阴极反应为6H2O+6e-=6OH-+3H2![]() ,阳极依次发生的反应为2Cl-—2e-=Cl2
,阳极依次发生的反应为2Cl-—2e-=Cl2![]() ,CO(NH2)2+3Cl2+H2O=N2+CO2+6HCl,根据上述反应式可以看出在阴、阳极上产生的OH、H+的数目相等,阳极室中反应产生的H+通过质子交换膜进入阴极室与OH恰好反应生成水,所以阴极室中电解前后溶液的pH不变;电解收集到的13.44L气体,物质的量为
,CO(NH2)2+3Cl2+H2O=N2+CO2+6HCl,根据上述反应式可以看出在阴、阳极上产生的OH、H+的数目相等,阳极室中反应产生的H+通过质子交换膜进入阴极室与OH恰好反应生成水,所以阴极室中电解前后溶液的pH不变;电解收集到的13.44L气体,物质的量为![]() =0.6mol,根据得失电子守恒知产生的H2、N2、CO2物质的量之比为3:1:1,则n(N2)= n(CO2)= 0.6mol×
=0.6mol,根据得失电子守恒知产生的H2、N2、CO2物质的量之比为3:1:1,则n(N2)= n(CO2)= 0.6mol×![]() =0.12mol,可知生成0.12molN2所消耗的CO(NH2)2的物质的量也为0.12mol,可以求出其质量;
=0.12mol,可知生成0.12molN2所消耗的CO(NH2)2的物质的量也为0.12mol,可以求出其质量;
(5)①要把铜从铜盐中置换铜出来,Cu被还原,则需要加入还原剂;
②根据图示信息,pH=8~9之间,反应速率为0,所以要使反应停止,调节溶液的pH至8~9 之间。
(1)反应物断裂化学键所需要吸收的总能量减去生成物形成化学键释放的总能量即为焓变:ΔH=[(945+498)-2×630] kJ·mol-1=+183 kJ·mol-1,热化学方程式为:N2(g)+O2(g)=2NO(g) ΔH=+183kJ·mol-1;
(2)①图1是原电池,依据电流流向是从正极流向负极,c电极为正极,氧气得到电子发生还原反应,d电极为电池负极,甲烷失电子发生还原反应,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导正极生成的O2-离子,负极(d极)电极反应为:CH4+4O2--8e-═CO2+2H2O;故答案为:正极; CH4+4O2--8e-═CO2+2H2O;/p>
②图2所示电解100mL0.5molL-1CuSO4溶液,发生的电解池反应为:2CuSO4+2H2O![]() 2Cu+O2↑+2H2SO4,与电源正极相连的为阳极,a极为阳极,溶液中氢氧根离子失去电子发生氧化反应,电极反应为:4OH--4e-═2H2O+O2↑;电解过程中CuSO4溶液每损失2个Cu原子,就损失2个 O原子,相当于损失一个CuO,为了使CuSO4溶液,恢复原浓度,应加入CuO,也可以加入CuCO3,符合恢复溶液浓度的定量关系,但不能加入Cu(OH)2、Cu2(OH)2CO3,因为CuCO3+H2SO4═CuSO4+CO2↑+H2O,相当于加CuO,而Cu(OH)2+H2SO4═CuSO4+2H2O、Cu2(OH)2CO3+2H2SO4═2CuSO4 +CO2↑+3H2O,除增加溶质外还增加了水,故选ac;
2Cu+O2↑+2H2SO4,与电源正极相连的为阳极,a极为阳极,溶液中氢氧根离子失去电子发生氧化反应,电极反应为:4OH--4e-═2H2O+O2↑;电解过程中CuSO4溶液每损失2个Cu原子,就损失2个 O原子,相当于损失一个CuO,为了使CuSO4溶液,恢复原浓度,应加入CuO,也可以加入CuCO3,符合恢复溶液浓度的定量关系,但不能加入Cu(OH)2、Cu2(OH)2CO3,因为CuCO3+H2SO4═CuSO4+CO2↑+H2O,相当于加CuO,而Cu(OH)2+H2SO4═CuSO4+2H2O、Cu2(OH)2CO3+2H2SO4═2CuSO4 +CO2↑+3H2O,除增加溶质外还增加了水,故选ac;
(3)该反应中Cu元素化合价由0价变为+2价、O元素化合价由0价变为-2价,要将该反应设计成原电池,Cu作负极,正极上氧气得电子发生还原反应,因为在酸性条件下,所以氧气得电子和氢离子反应生成水,电极反应式为4H++O2+4e- =2H2O;
(4)①由图可知,左室电极产物为Cl2,发生氧化反应,故A为电源的正极,右室电解产物H2,发生还原反应,故B为电源的负极,故答案为:B;
②由图可知,阳极室首先是氯离子放电生成氯气,氯气再氧化尿素生成氮气、二氧化碳,同时会生成HCl,阳极室中发生的反应依次为:2Cl--2e-=Cl2↑、CO(NH2)2+3Cl2+H2O=N2+CO2+6HCl;
③阴极反应为6H2O+6e-=6OH-+3H2![]() ,阳极依次发生的反应为2Cl-—2e-=Cl2
,阳极依次发生的反应为2Cl-—2e-=Cl2![]() ,CO(NH2)2+3Cl2+H2O=N2+CO2+6HCl,根据上述反应式可以看出在阴、阳极上产生的OH、H+的数目相等,阳极室中反应产生的H+通过质子交换膜进入阴极室与OH恰好反应生成水,所以阴极室中电解前后溶液的pH不变;电解收集到的13.44L气体,物质的量为
,CO(NH2)2+3Cl2+H2O=N2+CO2+6HCl,根据上述反应式可以看出在阴、阳极上产生的OH、H+的数目相等,阳极室中反应产生的H+通过质子交换膜进入阴极室与OH恰好反应生成水,所以阴极室中电解前后溶液的pH不变;电解收集到的13.44L气体,物质的量为![]() =0.6mol,根据得失电子守恒知产生的H2、N2、CO2物质的量之比为3:1:1,则n(N2)= n(CO2)= 0.6mol×
=0.6mol,根据得失电子守恒知产生的H2、N2、CO2物质的量之比为3:1:1,则n(N2)= n(CO2)= 0.6mol×![]() =0.12mol,可知生成0.12molN2所消耗的CO(NH2)2的物质的量也为0.12mol,其质量m[CO(NH2)2]=0.12mol×60gmol1=7.2g;
=0.12mol,可知生成0.12molN2所消耗的CO(NH2)2的物质的量也为0.12mol,其质量m[CO(NH2)2]=0.12mol×60gmol1=7.2g;
(5)①要把铜从铜盐中置换铜出来,Cu被还原,则需要加入还原剂与之反应,故答案为:还原剂;
②根据图示信息,pH=8~9之间,反应速率为0,所以要使反应停止,调节溶液的pH至8~9 之间,故答案为:调节溶液pH在8~9之间。


 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:高中化学 来源: 题型:
【题目】酒石酸是葡萄酒中特有的一种有机酸,葡萄酒的pH主要取决于酒石酸的含量,正常的葡萄酒pH约为2.9~3.8,常温下,酒石酸(用H2T表示)水溶液中三种微粒所占的分数(a)与pH的关系如图所示。下列表述不正确的是( )
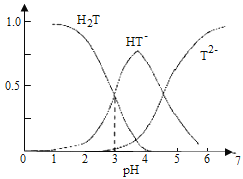
A.葡萄酒中除了存在酒石酸外,还存在酒石酸盐
B.常温下,H2T![]() H++HT-,Ka=10-3
H++HT-,Ka=10-3
C.当葡萄酒的pH为3.7时,HT-所占分数达到最大,此时葡萄酒中H2T>T2-
D.当HT-和T2-物质的量浓度相等时,溶液中水电离出来的氢离子浓度小于纯水中氢离子的浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】制作隐形眼镜的材料应该具有亲水性。聚甲基丙烯甲酯![]() 是制作隐形眼镜的材料之一。其合成路线如下:
是制作隐形眼镜的材料之一。其合成路线如下:

完成下列填空:
![]() 写出结构简式:E______;A的一种同分异构体,能与新制氢氧化铜反应______。
写出结构简式:E______;A的一种同分异构体,能与新制氢氧化铜反应______。
![]() 反应
反应![]() 的有机反应类型______。
的有机反应类型______。
![]() 反应
反应![]() 的试剂和反应条件______。
的试剂和反应条件______。
![]() 反应
反应![]() 的化学方程式______。
的化学方程式______。
![]() 聚甲基丙烯酸羟乙酯
聚甲基丙烯酸羟乙酯![]() 也可制作隐形眼镜
也可制作隐形眼镜![]() 结构简式见图
结构简式见图![]() ,用
,用 制作的隐形眼镜比PMMA制作的亲水性好,原因是______。
制作的隐形眼镜比PMMA制作的亲水性好,原因是______。
![]() 佩戴隐形眼镜最好常滴“人工眼泪”以滋润眼球。有一种“人工眼泪”成分是聚乙烯醇
佩戴隐形眼镜最好常滴“人工眼泪”以滋润眼球。有一种“人工眼泪”成分是聚乙烯醇
![]() 已知乙烯醇
已知乙烯醇![]() 不稳定,写出以乙炔为原料
不稳定,写出以乙炔为原料![]() 其他无机原料任选
其他无机原料任选![]() 制取聚乙烯醇的合成路线___________________。
制取聚乙烯醇的合成路线___________________。![]() 合成路线常用的表示方式为:
合成路线常用的表示方式为:![]() 目标产物
目标产物![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活密切相关,下列说法错误的是![]()
A.开发太阳能、风能、地热能、潮汐能等新能源可以减少霾的产生
B.硅胶可用作商品包装袋内的干燥剂,也可以用作催化剂的载体
C.铝合金的大量使用归功于人们能使用焦炭从氧化铝中获得铝
D.燃烧法可以鉴别羊毛和棉线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一反应:2E(g)+F(g)![]() 2G(g),图中曲线是该反应在不同温度下的平衡曲线,y轴表示F的转化率,图中有a、b、c三点,则下列描述中正确的是
2G(g),图中曲线是该反应在不同温度下的平衡曲线,y轴表示F的转化率,图中有a、b、c三点,则下列描述中正确的是

A. 该反应是放热反应
B. b点时混合气体的平均摩尔质量不再变化
C. T1温度下a点表示若想达到平衡,可以采取增大压强的方法
D. c 点可表V正逆
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废旧银锌纽扣电池(含Zn、Ag、石墨及少量Hg、Mn等)的正极片中回收银的工艺流程如下:
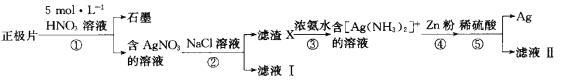
下列说法错误的是( )
A.①中会产生对大气有污染的气体
B.③的离子方程式为Ag++2NH3·H2O =[Ag(NH3)2] ++2H2O
C.⑤中加稀硫酸的目的是除去银粉中的锌
D.合理处理废旧电池有利于保护环境和资源再利用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室模拟工业漂白液(有效成分为NaClO)脱除废水中氨氮(NH3)的流程如下:
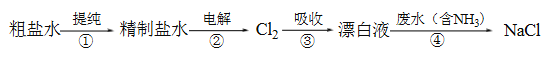
下列分析正确的是
A. ①中采用蒸馏的方法精制粗盐水
B. ②中阳极的主要电极反应:4OH- - 4e- = 2H2O + O2↑
C. ③中制备漂白液的反应:Cl2 + OH- = Cl- + HClO
D. ②、③、④中均发生了氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关图像的说法正确的是

A. 图甲表示:向某明矾溶液中逐滴加入NaOH溶液至过量,生成沉淀的物质的量与滴加NaOH溶液体积的关系
B. 图乙表示:向含等物质的量的NaOH和Na2CO3的混合溶液中逐滴加入稀盐酸至过量,生成气体的体积与滴加HCl溶液体积的关系
C. 图丙表示:在稀硝酸溶液中逐渐加入铁粉至过量,溶液中Fe3+物质的量与逐渐加入铁粉物质的量的变化关系
D. 除去混在硝酸钾中少量的氯化钠可用“蒸发浓缩、趁热过滤”的方法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于热化学反应的描述中正确的是
A. HCl和NaOH反应的中和热△H=-57.3 kJ·mol1,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ·mol1
B. 甲烷的标准燃烧热ΔH=-890.3 kJ·mol1,则CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH<-890.3 kJ·mol1
C. 已知:500℃、30MPa下,N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4kJ·mol-1;将1.5 mol H2和过量的N2在此条件下充分反应,放出热量46.2 kJ
2NH3(g) ΔH=-92.4kJ·mol-1;将1.5 mol H2和过量的N2在此条件下充分反应,放出热量46.2 kJ
D. CO(g)的燃烧热是283.0kJ·mol1,则2CO2(g) ===2CO(g)+O2(g)反应的△H=+566.0 kJ·mol1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com