
| A. | 浓盐酸在反应中仅体现还原性 | |
| B. | 被氧化和被还原的物质的物质的量之比为1:1 | |
| C. | 每生成0.1molClO2转移0.2mol电子 | |
| D. | 氧化性:NaClO3<Cl2 |
分析 2NaClO3+4HCl═2ClO2↑+Cl2↑+2H2O+2NaCl反应中,NaClO3中Cl元素化合价由+5价变为+4价、HCl中Cl元素的化合价从-1价变为0价,所以氯酸钠是氧化剂、盐酸是还原剂,再结合物质与电子之间的关系式解答.
解答 解:A.HCl中Cl元素的化合价从-1价变为0价,HCl作还原剂,同时生成NaCl,则还体现了HCl的酸性,故A错误;
B.NaClO3中Cl元素化合价由+5价变为+4价、HCl中Cl元素的化合价从-1价变为0价,根据电子守恒可知,被氧化和被还原的物质的物质的量之比为1:1,故B正确;
C.反应中生成2molClO2转移2mol电子,则每生成0.1molClO2转移0.1mol电子,故C错误;
D.反应中氯酸钠是氧化剂,氧化剂的氧化性大于氧化产物,则氧化性:NaClO3>Cl2,故D错误.
故选B.
点评 本题考查了氧化还原反应,根据元素化合价变化确定氧化剂、还原剂,注意该反应中元素得失电子时化合价不能交叉,为易错点,题目难度不大.


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | 能与NaOH溶液反应放出H2 | B. | 不能与硫酸铜溶液反应 | ||
| C. | 在常温下不能与O2反应 | D. | 遇冷浓硫酸不发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 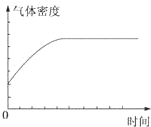 | B. | 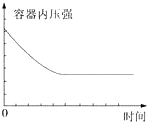 | ||
| C. | 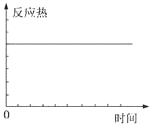 | D. | 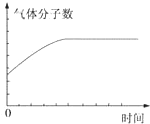 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 物质 | 叙述 | 判断 |
| A | 1molH2O | 标准状况下,其体积约为22.4L | 正确 |
| B | 2gH2 | 常温常压下,有NA个氢分子 | 错误 |
| C | 1L0.1mol?L-1NaCl溶液 | 取出100mL,NaCl的物质的量浓度为0.1mol?L-1 | 正确 |
| D | 1mol?L-1Na2SO4溶液 | 将1molNa2SO4固体溶于1L水可配得该溶液 | 正确 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
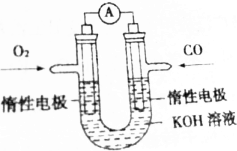 某实验小组将反应2CO(g)+O2(g)═2CO2(g)设计成如图所示的电池装置,负极的电极反应式为CO-2e-+2OH-=CO32-+H2O;正极的电极反应式为O2+2H2O+4e-=4OH-.电池工作时,正极区域溶液的pH变大(填“变大”“变小”或“不变”)用该原电池做电源,电解200mL饱和食盐水(足量),消耗的标准状况下的CO224mL,则溶液的pH=13.(不考虑溶液体积的变化)
某实验小组将反应2CO(g)+O2(g)═2CO2(g)设计成如图所示的电池装置,负极的电极反应式为CO-2e-+2OH-=CO32-+H2O;正极的电极反应式为O2+2H2O+4e-=4OH-.电池工作时,正极区域溶液的pH变大(填“变大”“变小”或“不变”)用该原电池做电源,电解200mL饱和食盐水(足量),消耗的标准状况下的CO224mL,则溶液的pH=13.(不考虑溶液体积的变化)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
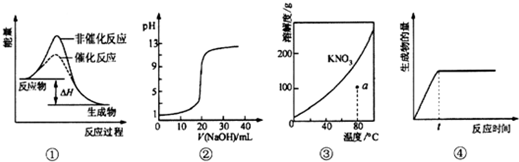
| A. | ①表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化 | |
| B. | ②表示0.1 mo1•L-1NaOH溶液滴定20 mL 0.1 mo1•L-1HCl溶液所得到的滴定曲线 | |
| C. | ③表示KNO3的溶解度曲线,图中a点所示的溶液是80℃时KNO3的不饱和溶液 | |
| D. | 某可逆反应生成物的量随反应时间关系如图④所示,在t时反应物转化率达到最大 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
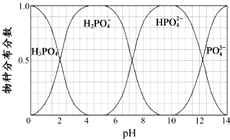 磷的重要化合物NaH2PO4、Na2HPO4和Na3PO4可通过H3PO4与NaOH溶液反应获得,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH 的关系如图所示.
磷的重要化合物NaH2PO4、Na2HPO4和Na3PO4可通过H3PO4与NaOH溶液反应获得,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH 的关系如图所示.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com