
| A. | Mg2+、Na+、Cl-、CO32- | B. | Fe2+、NO3-、Na+、Cl- | ||
| C. | NH4+、K+、AlO2-、SiO32- | D. | Cu2+、NH4+、SO42+、Na+ |
分析 A.镁离子与碳酸根离子反应生成碳酸镁沉淀;
B.四种离子之间不反应,能够共存,加入氢氧根离子醋酸氢氧化亚铁沉淀,加入氢离子醋酸NO气体;
C.铵根离子与偏铝酸根离子、硅酸根离子发生双水解反应,且加入氢氧根离子无沉淀生成,加入氢离子无气体产生;
D.四种离子之间不反应,能够共存,但是加入氢离子不会生成气体.
解答 解:A.Mg2+、CO32-之间发生反应,在溶液中不能大量共存,故A错误;
B.Fe2+、NO3-、Na+、Cl-之间不发生反应,能够大量共存,加入OH-有氢氧化亚铁沉淀析出,加入H+能放出NO气体,满足条件,故B正确;
C.NH4+与AlO2-、SiO32-之间发生双水解反应,在溶液中不能大量共存,故C错误;
D.Cu2+、NH4+、SO42+、Na+之间不发生反应,能够共存,但是加入H+不能放出气体,故D错误;
故选B.
点评 本题考查离子共存的正误判断,为中等难度的试题,注意明确离子不能大量共存的一般情况,如:能发生复分解反应的离子之间,能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,试题侧重对学生基础知识的训练和检验,有利于提高学生灵活运用基础知识的能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | v(A)=0.01 mol/(L•s) | B. | v(B)=0.02 mol/(L•s) | C. | v(B)=0.60mol/(L•s) | D. | v(C)=0.5mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 现有浓度均为0.1mol•L-1的下列溶液:①硫酸、②醋酸、③氢氧化钠、④氯化铵、⑤醋酸铵、⑥硫酸氢铵、⑦氨水,请回答下列问题:
现有浓度均为0.1mol•L-1的下列溶液:①硫酸、②醋酸、③氢氧化钠、④氯化铵、⑤醋酸铵、⑥硫酸氢铵、⑦氨水,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液氨汽化吸热,故液氨常做食品工厂的制冷剂 | |
| B. | 硅酸钠的水溶液俗称水玻璃,可用作木材防腐剂和阻燃剂 | |
| C. | 水晶项链和餐桌上的瓷盘都是硅酸盐制品 | |
| D. | 可用冷的浓硝酸迅速除去铝壶底的水垢 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
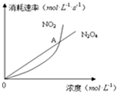 在80℃时,将0.40mol 的N2O4气体充入2L 已经抽成真空的固定容积的密闭容器中,发生如下反应:N2O4(g)?2NO2(g)△H=+56.9kJ/mol,隔一段时间对该容器内的物质进行分析,得到如下数据:
在80℃时,将0.40mol 的N2O4气体充入2L 已经抽成真空的固定容积的密闭容器中,发生如下反应:N2O4(g)?2NO2(g)△H=+56.9kJ/mol,隔一段时间对该容器内的物质进行分析,得到如下数据:| 时间/s n/mol | 0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4) | 0.40 | a | 0.20 | c | d | e |
| n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
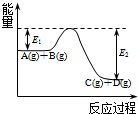 (1)北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6).丙烷脱氢可得丙烯.
(1)北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6).丙烷脱氢可得丙烯.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一种元素可能形成多种氧化物,但同价态的氧化物只有一种 | |
| B. | 明矾和漂白粉常用于自来水的净化和杀菌消毒,两者的作用原理相同 | |
| C. | 已知K2O、K2O2、KO2的名称依次是氧化钾、过氧化钾、超氧化钾,则BaO2的名称是过氧化钡 | |
| D. | 由共价键形成的物质一定是共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加热蒸干MgCl2饱和溶液,可制得氯化镁固体 | |
| B. | 明矾可用于水的消毒、杀菌 | |
| C. | 使用无磷洗衣粉,可缓解水体富营养化问题 | |
| D. | 用加热法可除去硬水中的CaCl2、MgCl2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com