
有人建议将氢元素排在元素周期表的VIIA族。下列事实能支持这一观点的是 ( )
(1)H原子得到一个电子实现最外电子层稳定结构;
(2)氢分子的结构式为H—H;
(3)与碱金属元素形成离子化合物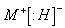 ;
;
(4)分子中原子间的化学键都属于非极性键
A.只有①②③ B.只有①③④ C.只有②③④ D.有①②③④
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
氯化硼的熔点为-107℃,沸点为12.5℃,在其分子中键与键之间的夹角为120o,它能水解,
有关叙述正确的是:
A.氯化硼液态时能导电而固态时不导电
B.氯化硼加到水中使溶液的pH升高
C.氯化硼遇水蒸气会产生白烟
| |
查看答案和解析>>
科目:高中化学 来源: 题型:
在一恒定的容器中充入2 mol X和1 mol Y发生反应:2X(g)+Y(g) nZ(g)达到平衡后,Z的体积分数为a%;若维持容器的容积和温度不变,按起始物质的量X为0.6 mol,Y为0.3 mol,Z为1.4 mol充入容器中,达到平衡后,Z的体积分数仍为a%,则n的值为( )。
nZ(g)达到平衡后,Z的体积分数为a%;若维持容器的容积和温度不变,按起始物质的量X为0.6 mol,Y为0.3 mol,Z为1.4 mol充入容器中,达到平衡后,Z的体积分数仍为a%,则n的值为( )。
A.可能为2,也可能为3 B.只能为3
C.只能为2 D.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
铜单质及其化合物在很多领域中都有重要的用途。请回答以下问题:
(1)超细铜粉可用作导电材料、催化剂等,其制备方法如下:
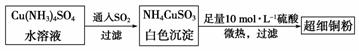
①NH4CuSO3中金属阳离子的核外电子排布式为 。N、O、S三种元素的第一电离能大小顺序为 (填元素符号)。
②Cu(NH3)4SO4中所含的化学键有
 (2)铜锰氧化物(CuMn2O4)能在常温下催化氧化空气中的一氧化碳和甲醛(HCHO)。根
(2)铜锰氧化物(CuMn2O4)能在常温下催化氧化空气中的一氧化碳和甲醛(HCHO)。根
据等电子体原理,CO分子的结构式为 。
(3)氯和钾与不同价态的铜可生成两种化合物,其阴离子均为无限长链结构(如图所示),a位置上Cl原子的杂化轨道类型为 。已知其中一种化合物的化学式为KCuCl3,则另一种化合物的化学式为
 (4) Cu2O的晶胞结构如图所示,该晶胞的边长为a cm,则Cu2O的密度为 g·cm-3(用NA表示阿伏加德罗常数的数值)。
(4) Cu2O的晶胞结构如图所示,该晶胞的边长为a cm,则Cu2O的密度为 g·cm-3(用NA表示阿伏加德罗常数的数值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A. 非金属元素R所形成的含氧酸盐(NaROb)中的R元素必定呈现正价
B. 只有非金属能形成含氧酸或含氧酸盐
C. 除稀有气体外的非金属元素都能生成不同价态的含氧酸
D.非金属的最高价含氧酸都具有强氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
有四组同族元素的物质,在101.3 kPa时测定它们的沸点(℃)如下表所示:
| 第一组 | He -268.8 | (a) -249.5 | Ar -185.8 | Kr -151.7 |
| 第二组 | F2 -187.0 | Cl2 -33.6 | (b) 58.7 | I2 184.0 |
| 第三组 | (c) 19.4 | HCl -84.0 | HBr -67.0 | HI -35.3 |
| 第四组 | H2O 100.0 | H2S -60.2 | H2Se -42.0 | H2Te -1.8 |
下列各项中正确的是( )
A.a、b、c的化学式分别为Ne2、Br2、HF
B.第二组物质只表现氧化性,不表现还原性
C.第三组物质中C的沸点最高,是因为C分子内存在氢键
D.第四组中各化合物的稳定性顺序为:H2O>H2S> H2Se>H2Te
查看答案和解析>>
科目:高中化学 来源: 题型:
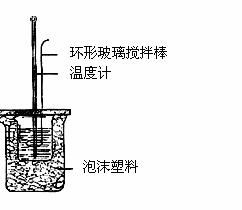
(1)中和热的测定实验(如图)。
①量取反应物时,取50 mL 0.50 mol/L的盐酸,还应
加入的试剂是 (填序号)。
A.50 mL 0.50 mol/LNaOH溶液
B.50 mL 0. 55 mol/LNaOH溶液
C.1.0 g NaOH固体
②在实验过程中,该同学需要测定并记录的实验数据有 (填序号)。
A.盐酸的浓度 B.盐酸的温度 C.氢氧化钠溶液的浓度
D.氢氧化钠溶液的温度 E.水的比热容 F.反应后混合溶液的最高温度
③若用50 mL 0.50 mol/L的醋酸溶液代替上述盐酸测定中和热,所得数据 (填“偏大”或“偏小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
NA表示阿伏加德罗常数,下列说法中不正确的是
A.KIO3+6HI=KI+3H2O+3I2 ,生成3mol I2转移电子的总数为5NA
B.标准状况下,5.6 L氧气中含有O的总数为0.5NA
C.25℃时,pH=13的Ba(OH)2溶液1.0L中含有OH-总数为0.1NA
D.20 g重水(D2O)中所含电子总数为8NA
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中不正确的是
A、共价化合物一定有极性共价键,可能含有离子键
B、离子化合物一定含离子键,可能含非极性共价键
C、元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素
D、短周期中含有五种金属元素
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com