

| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需 时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
| 1 |
| 2 |
| ||
| ||
| 1 |
| 2 |
| 250mL |
| 25mL |
| 137.5g/mol×0.0058mol |
| 1g |


 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案科目:高中化学 来源: 题型:
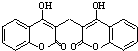 [选修5--有机化学基础]
[选修5--有机化学基础]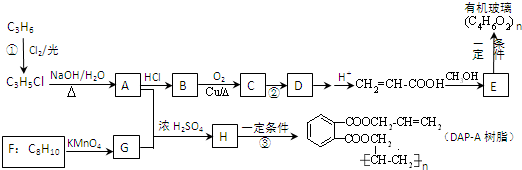
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、6.4g | B、4.8g |
| C、2.4g | D、1.6g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若为恒容容器,当a:b:c为2:2:1时,平衡不移动 |
| B、若在2min达平衡时,A物质的变化浓度为0.3mol/L,则用C表示该反应速率为0.3mol/(L?min) |
| C、若为恒压容器,当a:b为9:10,c为任意值时,平衡后A的质量分数一定仍为w% |
| D、若为恒压容器,当a=b=0,且c为任意值时,平衡后A的质量分数小于w% |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯酸钾、碳单质、液态氯化钠、液氨、王水 |
| B、双氧水、稀有气体、碱式碳酸镁、硫酸铜溶液、明矾 |
| C、烧碱、纯碱、火碱、天然气、乙酸 |
| D、二氧化锰、硫单质(S8)、NH3?H2O、纯净空气、H2O和D2O组成的混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
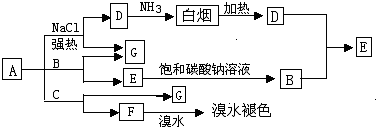
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com