
| A. | 将氯气通入氢氧化钡溶液中:Cl2+2 OH-=H2O+Cl-+ClO- | |
| B. | 贝壳溶于醋酸:CaCO3+2H+=Ca2++CO2↑+H2O | |
| C. | 铁与FeCl3溶液反应:Fe+Fe3+=2Fe2+ | |
| D. | 硫酸溶液与氢氧化钡溶液混合:Ba2++OH -+H++SO42-=BaSO4↓+H2O |
分析 A.反应生成氯化钡、次氯酸钡、水;
B.醋酸在离子反应中保留化学式;
C.反应生成氯化亚铁、电子、电荷不守恒;
D.不符合离子的配比.
解答 解:A.将氯气通入氢氧化钡溶液中的离子反应为Cl2+2 OH-=H2O+Cl-+ClO-,故A正确;
B.贝壳溶于醋酸的离子反应为CaCO3+2CH3COOH═Ca2++2CH3COO-+CO2↑+H2O,故B错误;
C.铁与FeCl3溶液反应的离子反应为Fe+2Fe3+=3Fe2+,故C错误;
D.硫酸溶液与氢氧化钡溶液混合的离子反应为Ba2++2OH -+2H++SO42-=BaSO4↓+2H2O,故D错误;
故选A.
点评 本题考查离子反应方程式的书写,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重分析与应用能力的考查,注意离子反应中保留化学式的物质及电子、电荷守恒,题目难度不大.


科目:高中化学 来源: 题型:填空题
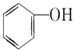 B.
B.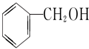 C.甲醇 D.CH3-O-CH3 E.HO-CH2CH2-OH
C.甲醇 D.CH3-O-CH3 E.HO-CH2CH2-OH查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去苯中的苯酚可以加入过量浓溴水后过滤 | |
| B. | 向浓硫酸中缓慢加入乙醇和冰醋酸用以制备乙酸乙酯 | |
| C. | 向2mL 10% NaOH溶液中,加入2mL 2mol/L CuSO4溶液,振荡制Cu(OH)2悬浊液,用于检验醛的性质 | |
| D. | 加入Mg(OH)2固体可除去MgCl2溶液中混有的少量FeCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正极发生的电极反应为H2O2+2H++2e-═2H2O | |
| B. | 电池总反应为Mg+H2O2═Mg(OH)2 | |
| C. | 工作时,正极周围海水的pH减小 | |
| D. | 电池工作时,溶液中的H+向负极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | +2 | -2 |
| A. | L、R的单质与稀盐酸反应速率L<R | |
| B. | M与T形成的化合物有两性 | |
| C. | Q、T两元素的氢化物分子间都存在氢键 | |
| D. | L、Q形成的简单离子核外电子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 乙醇是一种非常重要的烃的衍生物,是无色有特殊气味的液体.某校化学兴趣小组对乙醇的结构和性质进行了以下探究,请你参与并完成对有关问题的解答.
乙醇是一种非常重要的烃的衍生物,是无色有特殊气味的液体.某校化学兴趣小组对乙醇的结构和性质进行了以下探究,请你参与并完成对有关问题的解答.| 实验现象 | 结 论 | |
| ① | 钠沉在乙醇下面 | 钠的密度大于乙醇 |
| ② |
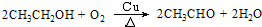 .欲验证此实验的有机产物,可以将产物加入盛有新制的氢氧化铜的试管中并在酒精灯火焰上直接加热,观察现象即可,此反应的化学方程式为CH3CHO+2Cu(OH)2$\stackrel{△}{→}$CH3COOH+Cu2O↓+2H2O.
.欲验证此实验的有机产物,可以将产物加入盛有新制的氢氧化铜的试管中并在酒精灯火焰上直接加热,观察现象即可,此反应的化学方程式为CH3CHO+2Cu(OH)2$\stackrel{△}{→}$CH3COOH+Cu2O↓+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| X | Y | 电解质溶液 | |
| A | Zn | Cu | ZnCl2溶液 |
| B | Cu | Zn | 稀H2SO4 |
| C | Cu | Zn | CuSO4溶液 |
| D | Zn | Zn | CuSO4溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
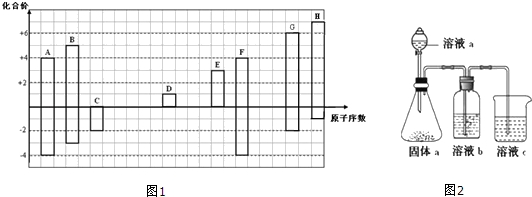
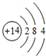 .
.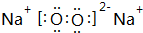 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com