
【题目】下列对NaCl的分类正确的是( )
A.混合物
B.化合物
C.氧化物
D.有机物
 全程金卷系列答案
全程金卷系列答案科目:高中化学 来源: 题型:
【题目】一种离子晶体的晶胞如图,其中阳离子A以![]() 表示,阴离子B以
表示,阴离子B以![]() 表示。
表示。
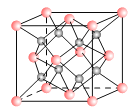
(1)每个晶胞中含A离子的数目为______,含B离子数目为_______。
(2)若A的核外电子排布与Ne相同,B的电子排布与Ar相同,则该离子化合物的化学式是___________;
(3)阳离子周围距离最近的阳离子数为_____,阳离子周围距离最近的阴离子数_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用98%、密度为1.84g/cm3的浓硫酸配制0.2mol/L的H2SO4溶液450mL.
(1)需要使用的主要仪器有量筒、烧杯、玻璃棒、___________、__________。
(2)其操作步骤可分解为以下几步:
A.用量筒量取______mL浓硫酸,缓缓注入装有约50mL蒸馏水的烧杯里,并用玻璃棒搅拌。
B.用适量蒸馏水分三次洗涤烧杯和玻璃棒,将每次的洗液都移入容量瓶里。
C.将稀释后的硫酸小心地用玻璃棒引流容量瓶里。
D.检查容量瓶是否漏水。
E.将蒸馏水直接加入容量瓶,至液面接近刻度线1-2cm处。
F.盖紧瓶塞,反复颠倒振荡,摇匀溶液。
G.用胶头滴管向容量瓶里逐滴加入蒸馏水,到液面最低点恰好与刻线相切。
请据此填写:
①完成上述步骤中的空白处。
②补充完成正确的操作顺序(用字母填写):______
( D )→( A )→( )→( )→( )→( )→( F )。
③将浓硫酸在烧杯中稀释后移入容量瓶时,必须_________________方可移液.
(3)试分析下列操作对所配溶液的浓度有何影响:
①量取浓硫酸时眼睛俯视刻度线,会导致所配溶液浓度会________;(填: 偏高、偏低、或无影响,下同)
②定容时,眼睛俯视刻度线,所配溶液浓度会___________;
③定容后,加盖倒转摇匀后,发现溶面低于刻度线,又滴加蒸馏水至刻度。所配溶液浓度会________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示某化学反应过程中,生成物的量与时间的关系,图中a、b、c三条曲线不能反映下列哪种因素对生成物的量的影响( )

A. 不同的温度 B. 不同的pH值
C. 不同的底物浓度 D. 不同的酶浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质A在无催化条件和有酶催化条件下生成物质P所需的能量变化如图,下列相关叙述正确的是( )
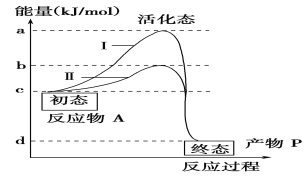
A. 若Ⅱ表示酶促反应曲线,则加热加压曲线应该在Ⅰ、Ⅱ之间
B. bd段表示在有酶催化剂条件下,物质A生成物质P化学反应顺利进行所提供的活化能
C. 若增加酶的量,则图中曲线的原有形状不发生改变
D. 曲线Ⅱ可表示最适酶促条件下的曲线,该反应只能在细胞内进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对Al2O3、Fe2O3的说法正确的是
A. 都是碱性氧化物 B. 都是白色、难溶于水的固体
C. 都能与NaOH溶液反应 D. 都能与盐酸反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫单质及其化合物在化工生产、污水处理等领域应用广泛。
(1)煤制得的化工原料气中含有羰基硫(O=C=S),该物质可转化为H2S,主要反应如下:
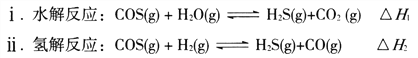
已知反应中相关的化学键键能数据如下表:
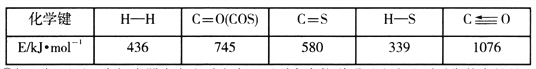
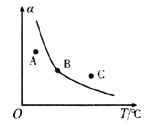
①一定条件下,密闭容器中发生反应i,其中COS(g)的平衡转化率(![]() )与温度(T)的关系如图所示。则A、B、C三点对应的状态中,v(COS)=v(H2S)的是____________。(填标号)
)与温度(T)的关系如图所示。则A、B、C三点对应的状态中,v(COS)=v(H2S)的是____________。(填标号)
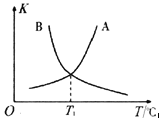
②反应ii的正、逆反应的平衡常数(K)与温度(T)的关系如图所示,其中表示逆反应的平衡常数(K逆)的是__________(填“A”或“B”)。T1℃时,向容积为10 L的恒容密闭容器中充入2 mol COS(g)和1 mol H2(g),发生反应ii,COS的平衡转化率为_____________。
(2)过二硫酸是一种强氧化性酸,其结构式为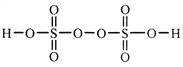
①在Ag+催化作用下,S2O82-能与Mn2+在水溶液中发生反应生成SO42-和MnO4-,该反应的离子方程式为________________________。
②工业上可用惰性电极电解硫酸和硫酸铵混合溶液的方法制备过二硫酸铵。总反应的离子方程式为________________________________。
(3)NaHS可用于污水处理的沉淀剂。已知:25℃时,反应Hg2+(aq)+HS-(aq) ![]() HgS(s)+H+(aq)的平衡常数K=1.75×1038,H2S的电离平衡常数Ka1=1.0×10-7,Ka2=7.0×10-15。
HgS(s)+H+(aq)的平衡常数K=1.75×1038,H2S的电离平衡常数Ka1=1.0×10-7,Ka2=7.0×10-15。
①NaHS的电子式为____________________。②Ksp(HgS)=_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. 用硝酸酸化的AgNO3 溶液可鉴别NaCl、 NaBr、 KI 三种溶液
B. 可用饱和NaCl溶液除去Cl2中的HCl 气体
C. 用加热方法可除去Na2CO3固体中的NaHCO3
D. 可用饱和Na2CO3溶液除去CO2中的HCl 气体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com