
| 选项 | 实验操作和现象 | 结论 |
| A | 取少量待检验溶液,向其中加入少量新制氯水,在滴加KSCN溶液,溶液呈血红色 | 待测液中含有Fe3+ |
| B | 室温下,向浓度均为0.1mol•L-1的BaCl2和CaCl2混合溶液中滴加Na2SO4溶液,出现白色沉淀. | Ksp(Ba2SO4)<Ksp(Ca2SO4) |
| C | 室温下,向FeCl3溶液中滴加少量KI溶液,再滴加几滴淀粉溶液,溶液变蓝色 | Fe3+的氧化性比I2的强 |
| D | 室温下,用PH试纸测得:0.1mol•L-1 Na2SO3溶液的PH约为10;0.1mol•L-1 NaHSO3溶液的PH约为5 | HSO3-结合H+的能力比SO32-的强 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.Fe2+检验时要先加KSCN溶液后加氯水,防止Fe3+干扰;
B.硫酸钡、硫酸钙均为白色沉淀;
C.溶液变蓝,说明生成碘单质,据此可判断铁离子与碘单质的氧化性;
D.0.1mol•L-1 NaHSO3溶液的PH约为5,说明NaHSO3溶液的电离大于其水解,Na2SO3溶液水解显碱性.
解答 解:A.二价铁离子和KCN不反应,三价铁离子和KSCN溶液反应生成血红色,二价铁离子易被氯水氧化生成三价铁离子,Fe2+检验时要先加KSCN溶液后加氯水,防止Fe3+干扰,故A错误;
B.硫酸钡、硫酸钙均为白色沉淀,则有白色沉淀生成,不能比较Ksp,故B错误;
C.室温下,向FeCl3溶液中滴加少量KI溶液,再滴加几滴淀粉溶液,溶液变蓝色,说明铁离子将碘离子氧化成碘单质,则Fe3+的氧化性比I2的强,故C正确;
D.NaHSO3溶液电离大于其水解,Na2SO3溶液水解显碱性,则HSO3-结合H+的能力比SO32-的弱,故D错误;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、发生的反应、Ksp比较、氧化性比较、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.


 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案科目:高中化学 来源: 题型:实验题
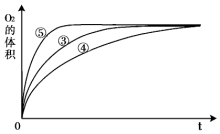 某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如表方案完成实验.
某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如表方案完成实验.| 实验编号 | 反应物 | 催化剂 |
| ① | 10mL2% H2O2溶液 | 无 |
| ② | 10mL5% H2O2溶液 | 无 |
| ③ | 10mL5% H2O2溶液 | 1mL0.1mol•L-1FeCl3溶液 |
| ④ | 10mL5% H2O2溶液+少量HCl溶液 | 1mL0.1mol•L-1FeCl3溶液 |
| ⑤ | 10mL5% H2O2溶液+少量NaOH溶液 | 1mL0.1mol•L-1FeCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ①②④ | C. | ②③④ | D. | ①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C4H10(g)+O2(g)═4CO2(g)+5H2O(l)△H=-QkJ•mol-1 | |
| B. | C4H10(g)+O2(g)═4CO2(g)+5H2O(l)△H=-10QkJ•mol-1 | |
| C. | C4H10(g)+O2(g)═4CO2(g)+5H2O(l)△H=+10QkJ•mol-1 | |
| D. | C4H10(g)+O2(g)═4CO2(g)+5H2O(g)△H=-10QkJ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 白色固体一定只含有硫酸铵 | |
| B. | 若氢氧化钠溶液足量,则生成氨气的体积应为6.72L(标况) | |
| C. | 从上述数据能求算出白色固体中(NH4)2SO4、NH4HSO4的物质的量之比为1:2 | |
| D. | 将某白色固体加热分解,若产生的气体不能使湿润的红色石蕊试纸变蓝,则该固体中一定不含铵盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 16g O2和O3的混合气体中含有的分子数为0.5NA | |
| B. | 25℃时,KSP(BaSO4)=1×10-10,则BaSO4饱和溶液中Ba2+数目为1×10-5NA | |
| C. | 标准状况下,2.24L Cl2通入足量H2O或NaOH溶液中转移的电子数均为0.1NA | |
| D. | 常温下,1mol的NaHCO3固体中含HCO3-的数目为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com