
【题目】钠、钾的碘化物在生产和科学实验中有十分重要的应用。工业利用碘、NaOH和铁屑为原料可生产碘化钠,其生产流程如图所示:
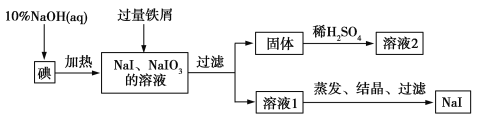
(1)NaOH溶液和碘反应时需要严格控制温度,如果温度过低,会生成碘的低价副产品NaIO。若NaOH溶液和碘反应时所得溶液中IO![]() 与IO-的物质的量之比为1∶1,则该反应的离子方程式为 。
与IO-的物质的量之比为1∶1,则该反应的离子方程式为 。
(2)生产流程中加入过量铁屑的目的是__________________,过滤所得固体中除剩余铁屑外,还有红褐色固体,则加入铁屑时发生反应的化学方程式是__________________。
(3)溶液2中除含有H+外,一定含有的阳离子是_______________;试设计实验证实该金属阳离子的存在:___________________。
(4)溶液2经一系列转化可以得到草酸亚铁晶体(FeC2O4·2H2O),称取3.60 g草酸亚铁晶体(相对分子质量是180)用热重法对其进行热分解,得到剩余固体的质量随温度变化的曲线如图所示:

①分析图中数据,根据信息写出过程I发生的化学方程式:____________ ______。
②300℃时剩余固体只有一种且是铁的氧化物,试通过计算确定该氧化物的化学式:______________。
【答案】(1)4I2+8OH-===IO![]() +6I-+4H2O+IO-
+6I-+4H2O+IO-
(2)还原IO![]() (或使IO
(或使IO![]() 转化为I-)(合理即可) NaIO3+2Fe+3H2O===NaI+2Fe(OH)3↓
转化为I-)(合理即可) NaIO3+2Fe+3H2O===NaI+2Fe(OH)3↓
(3)Fe2+ 取少量试样溶液于试管中,先加KSCN溶液无现象,再加氯水,溶液变红
(4)①FeC2O4·2H2O![]() FeC2O4+2H2O↑ ②Fe2O3
FeC2O4+2H2O↑ ②Fe2O3
【解析】
试题分析:(1)若NaOH溶液和碘反应时所得溶液中碘酸根离子与IO-离子的物质的量之比为1:1,碘失去电子为6个,根据得失电子守恒,生成的I-为6个,参加反应的碘单质为4个,则上述过程中,反应的离子方程式为4I2+8OH-===IO![]() +6I-+4H2O+IO-。
+6I-+4H2O+IO-。
(2)反应加入铁屑的目的是还原反应中所生成的碘酸根离子,生成的红褐色沉淀为氢氧化铁,相应的化学方程式为NaIO3+2Fe+3H2O===NaI+2Fe(OH)3↓。
(3)由于铁过量,所以所得固体中存在氢氧化铁和单质铁,当加入稀硫酸时,氢氧化铁溶解生成铁离子,而单质铁则与铁离子或氢离子反应,会生成亚铁离子,一定有亚铁离子,检验亚铁离子的方法为取少量试样溶液于试管中,先加KSCN溶液无现象,再加氯水,溶液变红,证明存在亚铁离子,或加入K3[Fe(CN)6]产生蓝色沉淀。
(4)①通过剩余固体的质量可知,过程Ⅰ发生的反应是草酸亚铁晶体受热失去结晶水,反应的方程式为FeC2O4·2H2O![]() FeC2O4+2H2O↑。
FeC2O4+2H2O↑。
②草酸亚铁晶体中铁的元素质量为3.6×56/180×100%=1.12克,草酸亚铁晶体中的铁元素完全转化到氧化物中,氧化物中氧元素的质量为1.60-1.12=0.48克,铁元素与氧元素的质量为1.12:0.48=7:3,设铁的氧化物的化学式为FexOy,则有56x:16y=7:3,x:y=2:3,所以固体为Fe2O3。


科目:高中化学 来源: 题型:
【题目】化学与人类的生活息息相关,下列有关说法正确的是( )
A. 因铝表面能形成致密的氧化膜,所以铝制餐具可以长期使用
B. 纤维的应用很广,人造纤维、合成纤维和光导纤维都是有机高分子化合物
C. 新买的衣服先用水清洗,可除去衣服上残留的有防皱作用的甲醛整理剂
D. 磨豆浆的大豆富含蛋白质,豆浆煮沸后蛋白质变成了氨基酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A.氯气和水发生反应:Cl2+H2O![]() 2H++Cl-+ClO-
2H++Cl-+ClO-
B.用氢氧化钠除去铝表面的氧化膜时产生气泡的反应2Al+2OH-+6H2O = 2[Al(OH)4]-+3H2↑
C.金属钠和水反应:Na+2H2O=Na++2OH-+H2↑
D.将金属铁加入稀硫酸和硝酸钾混合溶液中,金属溶解:Fe+2H+=Fe2++H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验能成功的是( )
A. 将乙酸和乙醇混合加热制乙酸乙酯 B. 苯和浓溴水反应制溴苯
C. CH3CH2Br中滴加AgNO3溶液观察是否有淡黄色沉淀,判断卤代烃的类型 D. 用CuSO4溶液和过量NaOH溶液混合,然后加入几滴乙醛,加热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对充有氖气的霓虹灯管通电,灯管发出红色光。产生这一现象的主要原因( )
A. 在电流的作用下,氖原子与构成灯管的物质发生反应
B. 电子由基态向激发态跃迁时吸收除红光以外的光线
C. 氖原子获得电子后转变成发出红光的物质
D. 电子由激发态向基态跃迁时以光的形式释放能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素X的原子有3个电子层,最外层有4个电子.该元素位于周期表的( )
A.第4周期ⅢA族
B.第4周期ⅦA族
C.第3周期ⅣB族
D.第3周期ⅣA族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】测定1 mol氧气在标准状况下所占体积的实验操作的步骤如下:
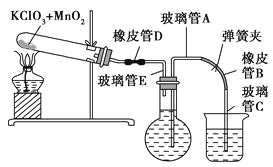
①按下图装配实验装置。
②洗净试管然后充分干燥。
③向500 mL烧瓶里装满水,向500 mL烧杯里加入少量水,把连接烧瓶和烧杯的玻璃管A、橡皮管B和玻璃管C中也装满水,在中间不要留下气泡,然后用弹簧夹把橡皮管B夹紧。
④称得试管的质量为14.45 g,往试管里加入KClO3和MnO2的混合物,再称其质量为15.95 g。
⑤打开弹簧夹,把烧杯举起使烧瓶和烧杯中的水面一致,再关闭弹簧夹,然后把烧杯中的水倒掉。
⑥打开弹簧夹,加热试管的混合物到不再产生气体,即水不再流向烧杯时为止。
⑦反应完毕后把装置冷却到室温。
⑧调节烧杯的高度使烧瓶和烧杯中的水面一致,然后再关闭弹簧夹。
⑨用500 mL量筒测量烧杯里水的体积为285.0 mL,把它换算为标准状况下氧气的体积为279.7 mL。
⑩再称量冷却后试管的质量为15.55 g。
(1)在操作⑦中,装置冷却时,玻璃管C的出口一直要在烧杯的水中,不能离开水面,其理由是 。
(2)简述操作⑧的必要性,即为什么要调节烧杯的高度,使烧瓶和烧杯中的水面一致? 。
(3)标准状况下,1 mol氧气所占的体积(保留小数后两位)为 L;混合物中MnO2的质量分数为
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com