
| A、丙炔 | B、环丁烷 | C、甲苯 | D、苯 |


科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
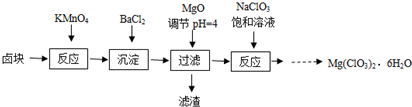
| A、卤块中加入KMnO4发生的氧化还原反应有2个 |
| B、加入BaCl2为沉淀SO42- |
| C、也可用Mg(OH)2代替MgO调节溶液的PH |
| D、在滤液中加NaClO3饱和溶液得到产品利用了相同温度下Mg(ClO3)2溶解度比NaClO3小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
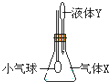 如图示装置中,将液体Y滴入瓶中并摇动,一会儿小气球胀大.则气体X与液体Y不可能是( )
如图示装置中,将液体Y滴入瓶中并摇动,一会儿小气球胀大.则气体X与液体Y不可能是( ) | A | B | C | D | |
| 气体X | NH3 | SO2 | CO2 | HCl |
| 液体Y | 水 | 浓NaOH | 稀H2SO4 | 食盐水 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A元素原子的核外p电子总数比s电子总数少1 |
| B元素原子p电子总数与s电子总数相等,且不与A元素在同一周期 |
| C原子所有轨道全满或半满 |
| D元素的主族序数与周期数的差为4 |
| E是前四周期中电负性最小的元素 |
| F在周期表的第七列 |
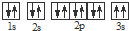 ,违背了
,违背了查看答案和解析>>
科目:高中化学 来源: 题型:
| |温度/℃ | 700 | 900 | 830 | 1000 | 1200 |
| 平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、③⑥ | B、②③⑦ |
| C、①③⑥ | D、③⑤⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com