
| A. | ①② | B. | ③④ | C. | ①③ | D. | ①④ |
科目:高中化学 来源: 题型:选择题
| A. | 用氨水吸收过量的SO2:2NH3•H2O+SO2=2NH4++SO32-+H2O | |
| B. | Ca(HCO3)2 溶液中加入少量澄清石灰水:HCO3-+Ca2++OH-=CaCO3↓+H2O | |
| C. | FeI2溶液中通入少量Cl2:2Fe2++Cl2=2Fe3++2Cl- | |
| D. | NaClO溶液和FeCl2溶液混合:2ClO-+Fe2++2H2O=Fe(OH)2↓+2HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | O2、O3互为同位素 | |
| B. | 1H、2H、3H、H+、H2是氢元素形成的五种不同粒子 | |
| C. | 正丁烷和异丁烷互为同素异形体 | |
| D. | 金刚石、C60互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A | |||||||||||||||||
| W | T | M | F | ||||||||||||||
| B | D | Z | J | L | H | V | |||||||||||
| C | E | G | Q | ||||||||||||||
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素周期表共18列,从左到右的第十七列为卤族元素 | |
| B. | 同一周期元素的原子,半径越小越容易失去电子 | |
| C. | 副族元素全部是金属元素 | |
| D. | 在过渡元素中,人们可以寻找到各种优良的催化剂和高温、耐腐蚀的合金材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
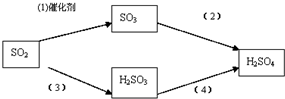 (1)黑火药爆炸时,发生的反应之一为:S+2KNO3+3C$\stackrel{引燃}{→}$K2S+3CO2↑+N2↑,该反应中氧化剂为S、KNO3,1molS能氧化C0.5mol
(1)黑火药爆炸时,发生的反应之一为:S+2KNO3+3C$\stackrel{引燃}{→}$K2S+3CO2↑+N2↑,该反应中氧化剂为S、KNO3,1molS能氧化C0.5mol查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com