
| A. | 常温时,溶液中c(CH3COO-):①<② | |
| B. | 加水稀释①,溶液中$\frac{c(C{H}_{3}COOH)•c(O{H}^{-})}{c(C{H}_{3}CO{O}^{-})}$变大 | |
| C. | 向②中滴加①至溶液呈中性,滴加过程中水的电离平衡正向移动 | |
| D. | 向②中滴加①至溶液呈中性,溶液中c(Na+)>c(CH3COO-) |
分析 A.醋酸为弱酸存在电离平衡,醋酸根离子水解程度弱;
B.加水稀释促进弱电解质电离和盐的水解,水解平衡常数和电离平衡常数只随温度变化;
C.酸抑制水的电离,水解的盐促进水的电离;
D.溶液呈中性c(H+)=c(OH-),溶液中存在电荷守恒.
解答 解:A.①0.1mol/L CH3COONa溶液 ②0.1mol/L CH3COOH溶液,醋酸电离出醋酸根离子浓度小,常温时,溶液中c(CH3COO-):①>②,故A错误;
B.醋酸钠溶液中存在水解平衡,CH3COO-+H2O?CH3COOH+OH-,Kh=$\frac{c(O{H}^{-})c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})}$加水稀释比值不变,故B错误;
C.①0.1mol/L CH3COONa溶液 中醋酸根离子水解促进水的电离平衡,②0.1mol/L CH3COOH溶液抑制水的电离,向②中滴加①至溶液呈中性,滴加过程中水的电离平衡正向移动,故C正确;
D.向②中滴加①至溶液呈中性c(H+)=c(OH-),溶液中存在电荷守恒c(H+)+c(Na+)=c(OH-)+c(CH3COO-),c(Na+)=c(CH3COO-),故D错误;
故选C.
点评 本题考查了弱电解质电离、盐类水解、平衡常数计算、电离平衡和水解平衡的影响因素分析,掌握基础是解题关键,题目难度中等.


 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案科目:高中化学 来源: 题型:选择题
| A. | Na+、NH4+、Cl+ | B. | Mg2+、Ba2+、Br- | C. | Mg2+、Cl-、Fe2+ | D. | K+、SiO32-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ①②③ | C. | ①④ | D. | ①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 28.58kJ | B. | 24.18kJ | C. | 57.16kJ | D. | 48.36kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等物质的量的水与重水含有的中子数 | |
| B. | 等质量的乙烯和丙烯中含有的共用电子对数 | |
| C. | 同温、同压、同体积的CO和NO含有的质子数 | |
| D. | 等物质的量的铁和铜分别与氯气完全反应,转移的电子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
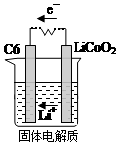 某锂离子电池用含有Li+的导电固体作为电解质.充电时,Li+还原为Li,并以原子形式嵌入电极材料碳C6中,以LiC6表示,电池反应为CoO2+Li C6$?_{放电}^{充电}$LiCoO2+C6.右图表示该装置工作时电子和离子的移动方向,此时C6电极是作为( )
某锂离子电池用含有Li+的导电固体作为电解质.充电时,Li+还原为Li,并以原子形式嵌入电极材料碳C6中,以LiC6表示,电池反应为CoO2+Li C6$?_{放电}^{充电}$LiCoO2+C6.右图表示该装置工作时电子和离子的移动方向,此时C6电极是作为( )| A. | 阴极 | B. | 阳极 | C. | 负极 | D. | 正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在0.1mol/L的NaHSO4溶液中,含阳离子总数为0.2NA | |
| B. | 由2gH2、88gCO2、36gH2O组成的混合气体,密度约是相同状况下O2密度的0.79倍 | |
| C. | 1molAl与足量Na0H溶液反应生成H2的体积为33.6L | |
| D. | 56gFe单质与足量S单质在加热条件下充分反应,转移电子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 6.2 g Na2O所含的离子数为0.2 NA | |
| B. | 46 gNO2与N2O4的混合气体中所含的原子数是3NA | |
| C. | 2.8 gN2中含有共用电子对的数目为0.1 NA | |
| D. | 0.1 molH2与Cl2的混合气体充分反应后,体系中含有共价键总数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
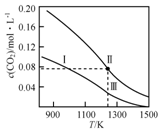 在体积均为1.0L的恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1molCO2和0.2molCO2,在不同温度下反应CO2(g)+C(s)?2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上).下列说法正确的是( )
在体积均为1.0L的恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1molCO2和0.2molCO2,在不同温度下反应CO2(g)+C(s)?2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上).下列说法正确的是( )| A. | 反应CO2(g)+C(s)?2CO(g)△S>0、△H<0 | |
| B. | 体系的总压强P总:P总(状态Ⅱ)=2P总(状态Ⅰ) | |
| C. | 体系中c(CO):c(CO,状态Ⅱ)<2c(CO,状态Ⅲ) | |
| D. | 逆反应速率V逆:V逆(状态Ⅰ)>V逆(状态Ⅲ) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com