
某温度下,在容积为2L的密闭容器中,发生X(g)+2Y(g) ![]() 2W(g)的反应,充入1molX和1molY,经20s达到平衡时生成了0.4molW。下列说法正确的是
2W(g)的反应,充入1molX和1molY,经20s达到平衡时生成了0.4molW。下列说法正确的是
A、若升高温度,W的体积分数减小,则该反应△H>0
B、以Y的浓度变化表示的反应速率为0.01mol/(L.s)
C、在其它条件不变的情况下,增加1molX,则X和Y的转化率均提高
D、增大压强,正反应速率增大,逆反应速率减小,则平衡向正反应方向移动
 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:阅读理解
 2009年12月7日一18日在丹麦首都哥本哈根召开的联合国气候会议,就未来应对气候变化的全球行动签署新的协议.而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视.为减小和消除CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO2创新利用的研究.
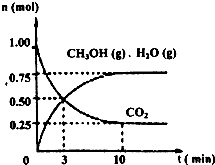
2009年12月7日一18日在丹麦首都哥本哈根召开的联合国气候会议,就未来应对气候变化的全球行动签署新的协议.而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视.为减小和消除CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO2创新利用的研究.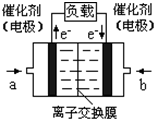 意图,则a处通入的是
意图,则a处通入的是查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
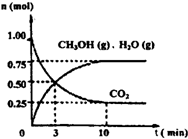 (2012?信阳二模)如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视.为减小和消除CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO2创新利用的研究.
(2012?信阳二模)如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视.为减小和消除CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO2创新利用的研究.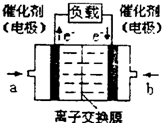
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(PCl3)?c(Cl2) |
| c(PCl5) |
| c(PCl3)?c(Cl2) |
| c(PCl5) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 0s | 20s | 40s | 60s | |
| n(A)/mol | a | 3.0 | 2.0 | 2.0 |
| n(B)/mol | 0 | 1.0 | 2.0 | c |
| n(C)/mol | 0 | 1.0 | b | 2.0 |
| A、反应在前20s内的平均速率为v(A)=0.05 mol?L-1?s-1 |
| B、40s时,反应的正反应速率和逆反应速率相等 |
| C、该温度下,反应的化学平衡常数为1 |
| D、若升高温度,则化学平衡常数减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com