
| A. | ①③⑤ | B. | ②④⑥ | C. | ②④⑤ | D. | ②⑦⑧ |
分析 ①铁和稀硫酸反应生成的是亚铁离子,不是铁离子;
②往FeCl3溶液中加入Fe粉生成氯化亚铁;
③氧化亚铁溶于稀硝酸,亚铁离子被氧化成铁离子;
④氯化铁水解生成的是氢氧化铁胶体,不能使用沉淀符号,且为可逆反应;
⑤离子方程式两边正电荷不相等,违反了电荷守恒;
⑥碳酸氢钠水解生成碳酸和氢氧根离子;
⑦通入过量二氧化硫于碳酸氢钠溶液,反应生成二氧化碳和亚硫酸氢根离子;
⑧氯气通入氢氧化钠溶液生成氯化钠、次氯酸钠和水.
解答 解:①铁和稀硫酸反应生成硫酸亚铁和氢气,正确的离子方程式为:Fe+2H+═Fe2++H2↑,故①错误;
②往FeCl3溶液中加入Fe粉,反应生成氯化亚铁,反应的离子方程式为:2Fe3++Fe═3Fe2+,故②正确;
③氧化亚铁溶于稀硝酸,反应生成硝酸铁和水,正确的离子方程式为:3FeO+NO3-+10H+═3Fe3++5H2O+NO↑,故③错误;
④氯化铁水解程度较小,氢氧化铁不能使用沉淀符号,正确的离子方程式为:Fe3++3H2O?Fe(OH)3+3H+,故④错误;
⑤氯化亚铁溶液中加入氯水,反应生成氯化铁,正确的离子方程式为:2Fe2++C12═2Fe3++2C1-,故⑤错误;
⑥碳酸氢钠水解生成碳酸和氢氧根离子,正确的离子方程式为:HCO3-+H2O?H2CO3+OH-,故⑥错误;
⑦通入过量二氧化硫于碳酸氢钠溶液,反应生成亚硫酸氢根离子和二氧化碳,反应的离子方程式为:SO2+HCO3-═CO2+HSO3-,故⑦正确;
⑧氯气通入氢氧化钠溶液,反应的离子方程式为:2OH-+C12═C1-+C1O-+H2O,故⑧正确;
故选D.
点评 本题考查了离子方程式的正误判断,题目难度中等,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)、检查是否符合原化学方程式等.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | I A | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | D | E | G | I | ||||
| 3 | B | C | F | H | ||||
| 4 | J | K |
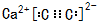 ,
,查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学式 | △H/(kJ?mol-1) | 化学式 | △H/(kJ?mol-1) |
| CO(g) | -283.0 | CH4(g) | -890.3 |
| H2(g) | -285.8 | CH3OH(l) | -726.5 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学变化一定伴随能量变化 | |
| B. | 化学变化一定有化学键的断裂和生成 | |
| C. | 化学变化一定伴随物质的状态变化 | |
| D. | 化学变化一定有新物质生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4个 | B. | 5个 | C. | 6个 | D. | 7个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
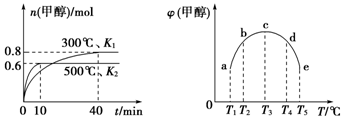
| A. | 该反应的△H1>0,且K1>K2 | |
| B. | 将容器c中的平衡状态转变到容器d中的平衡状态,可采取的措施有升温或加压 | |
| C. | 300℃时,向平衡后的容器中再充入0.8 mol CO,0.6 mol H2,0.2 mol CH3OH,平衡正向移动 | |
| D. | 500℃时,向平衡后的容器中再充入1 mol CH3OH,重新平衡后,H2浓度和百分含量均增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
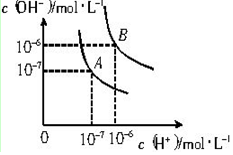
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质的量是国际单位制中七个基本物理量之一 | |
| B. | CH3COOK的摩尔质量为98 g | |
| C. | 1 mol CH3COOK含有2 mol氧 | |
| D. | 1 molCH3COOK含有3×6.02×1023个氢元素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com